Analysis of microbial diversity and community structure in thermal waters from Lindian geothermal field, Heilongjiang Province
-
摘要:研究目的
研究地热系统微生物群落组成有助于揭示地热流体地球化学演化和指示热储地球化学环境。已有研究显示,林甸地热田热水还原性强且富含甲烷,但关于微生物在甲烷形成中的作用研究较少。本文旨在分析林甸地热田热水中微生物的群落结构和多样性特征,并揭示其甲烷生成途径。
研究方法在地热供暖季和非供暖季采集并测试了9个热水微生物样品,并对热水中微生物多样性、群落结构及功能基因进行了分析。
研究结果属水平上,林甸地热水中优势细菌主要为不动杆菌属(Acinetobacter,>80%),与已有报道的地热系统有一定差异,而同油田热水相似;供暖季和非供暖季热水中细菌多样性差异较大,非供暖季细菌多样性高于供暖季,但古菌多样性基本不受开采影响;优势古菌以广古菌门(Euryarchaeota)产甲烷菌为主,地热流体中的甲烷气体主要源于H2还原CO2产甲烷途径,而甲基歧化产甲烷作用和H2还原甲基化合物产甲烷途径次之。
结论林甸地热田热水中微生物多样性和群落结构较为独特,与地层中有机质含量较高、地热开采扰动有关。
创新点:系统开展了林甸地热田热水微生物群落结构和多样性研究;识别了林甸地热流体中甲烷的成因机制。
Abstract:This paper is the result of geothermal survey engineering.
ObjectiveResearches on microbial community in geothermal systems is key to indicate geochemical environment and evolution of thermal fluids. Previous researches have shown that the thermal water in Lindian geothermal field is highly reducing and is rich in methane. The objective of this paper is to characterize the microbial diversity and community structure of the thermal water.
MethodsA total of 9 thermal water samples were collected and tested during exploitation and non-exploitation periods, and the microbial diversity, community structure and functional genes of the samples were analyzed.
ResultsThe dominant bacterial genera in the thermal water is mainly Acinetobacter, which is different from most geothermal systems reported, but are similar to that of oil fields. The bacterial diversity of the thermal waters during the exploitation period and the non-exploitation period is significantly different, i.e., the bacterial diversity in the non-exploitation period is higher than that in the exploitation period, while the archaeal diversity is not affected significantly by exploitation. The dominant archaea are mainly Euryarchaeota methanogens. Functional gene prediction of archaea shows that methane production in Lindian geothermal field is dominated by hydrogenotrophic methanogenesis, and secondarily by disproportionation of methyl groups and reduction of methyl compounds with H2.
ConclusionsThe microbial diversity and community structure of the thermal waters from Lindian geothermal field is relatively unique, which is related to the high content of organic matters and thermal water exploitation.
-
1. 引言
微生物是地下生态系统中的主要生命组分。地下水环境拥有微生物生长发育所需的营养、水分、pH、渗透压和温度等条件,可为微生物提供生存条件,构成其生长繁殖的介质环境。同时,微生物也是水文地球化学演化的重要驱动因子(艾明强等, 2010),但目前关于地下水中微生物的研究多集中于浅层地下水,而对地热系统的研究较少。已有研究中,又以高温热泉微生物种群的研究为最多,如美国黄石公园、印度尼西亚Padang Germin热泉及中国云南、西藏等地的热泉(Blank et al., 2002;Reysenbach and Shock, 2002;宋兆齐等, 2008, 2015;Aditiawati et al., 2009;沈继红等,2012;姜舟,2016;Zhang et al., 2019)。另外,随着微生物采油和油气微生物勘探技术的发展,关于油藏微生物群落的研究也颇为广泛(Kristjánsson and Hreggvidsson, 1995;王万春和陶明信,2005;张林晔等,2005;孟俞辰,2018;张蔚等,2019;Le et al., 2019),但仍鲜见对中低温地热系统微生物群落组成特征的研究。
林甸地热田位于黑龙江省大庆市林甸县,构造上属于松嫩盆地滨北地区中央断陷区的林甸断陷。林甸断陷地层沉积厚度大,为整个滨北地区的沉积和沉降中心。主要沉积了下白垩统营城组、沙河子组与上侏罗统火石岭组,最大沉积厚度为2500 m,从构造条件来看,有利于深层油气的生成和成藏(程日辉等,2006;张功成等,2019)。滨北地区由北向南至滨洲线附近发育了冲积相—三角洲相—半深湖相沉积。在白垩系泉头组四段、青山口组和嫩江组沉积时期,湖泊面积扩大,水体加深,使得局部范围内出现较深水还原环境,为生物气源岩的形成提供了较为丰富的物质基础(丁安娜等, 2004)。林甸地热田热储层即包括嫩江组、姚家组、青山口组和泉头组三、四段,其水溶气以甲烷为主。已有研究认为该甲烷是油藏伴生气的主要成分,主要为生物成因,系热储中未成熟有机质在还原环境下经微生物作用形成的(张道阔,2009;王杰,2017),但未就相关微生物群落做进一步研究。
因此,本研究基于林甸地热田代表性热水样品的宏基因组分类测序,分析地热水微生物群落结构和多样性,以期解释甲烷成因,揭示热储的地球化学环境,为地热田的成因研究提供依据,并丰富对地热微生物群落和生存环境的认识。
2. 样品采集和测试
2.1 研究区概况
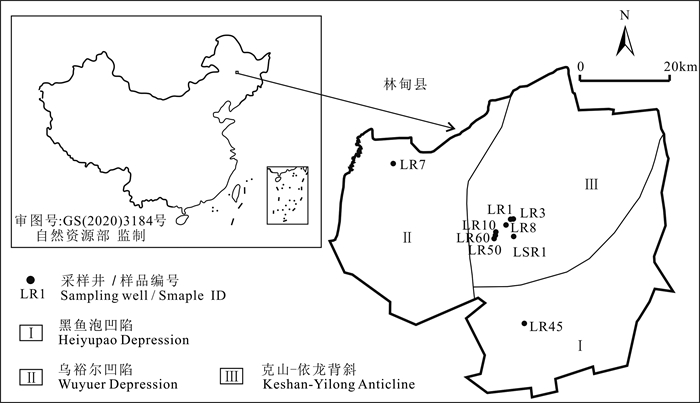
林甸地热田位于松嫩平原北部,面积约3500 km2(图 1),地理坐标为124°18′~125°21′E,46°44′~47°29′N。地形平坦开阔,地势由东北向西南缓倾,海拔约149~162 m,地形坡度较小,为2‰~4‰。该区是中、新生代盆地的沉积中心,沉积了白垩纪、早—中古近纪和第四纪等一系列河流-湖泊沉积物,沉积厚度大于3000 m。主要热储层为白垩系砂岩。顶板和底板埋深分别为980~1500 m和1670~2430 m。热储温度位于47.4~89.0℃,属中低温地热系统。由于部分热储地层为深水沉积,富含沼气源岩(孙小溪和蒋宏忱, 2020),热储流体中富含甲烷气体,其含量占水溶气的86.7%~90.8%(董俊领, 2013)。
2.2 采样与分析
本次研究中的微生物样品分两次采集。2019年1月(供暖季)采集地热田中心克山—依龙背斜构造带的热水样品5个,样品编号(采样井)分别为LR1、LR8、LR10、LR60和LR50;2021年8月(非供暖季)采集克山—依龙背斜构造带2个,样品编号(采样井)分别为LR3、LSR1;乌裕尔凹陷和黑鱼泡凹陷内热水样品各1个,样品编号(采样井)分别为LR7、LR45(图 1)。
样品测试项目包括水化学和微生物群落分析。水化学样品采集时,现场采用便携式多参数仪(Hach HQ40D)测量水温(T)、pH和总溶解固体(TDS),分辨率分别为0.3 ℃、0.01和0.1 mg/L。阴阳离子、二氧化硅样品经无菌0.22 μm滤膜过滤后,收集于500 mL高密度聚乙烯(HDPE)瓶中;总有机碳(TOC)样品采用50 mL瓶收集,并采用总有机碳分析仪(Shimadzu TOC-L CPH)测定,检测限为4 µg/L;溶解无机碳13C(13CDIC)样品采用500 mL HDPE瓶采集,由稳定同位素比质谱仪(Isoprime 100)测量,精度优于0.1‰。以上测试均在吉林大学测量科学与实验中心完成。
微生物样品现场过滤于0.22 μm聚四氟乙烯滤膜,然后将膜冷冻并送至上海生工生物科技有限公司进行测试。使用E.Z.N.A® Mag-Bind Soil DNA试剂盒提取基因组DNA,分别对细菌与古菌进行分析。对细菌进行了两轮聚合酶链反应(PCR)扩增。使用引物341F(CCTACGGGNGGCWGCAG)和805R(GACTACHVGGG-TATCTAATCC)结合Miseq测序,从分离的DNA中对细菌16S rDNA基因(V3-V4)进行第一轮扩增,第二轮扩增在PCR上引入兼容的引物。古菌PCR扩增包括三轮。在第一轮中,将分离的DNA用M-340F(CCCTAYGGGGYGCASCAG)和GU1ST-1000R(GGCCATGCACYWCYTCTC)引物扩增,第二轮使用引物349F(GYGCAS-CAGKCGMGAAW)和806R(GGACTACVSGGGTATCTAAT)进行了古细菌16S rDNA基因(V3-V4)扩增。第三轮扩增与第二轮细菌扩增相同。PCR扩增后的DNA通过AgencourtAmpureXP磁珠纯化,并通过Qubit 2.0TM DNA试剂盒定量。纯化的扩增子在Illumina MiSeq平台上进行测序。
基于核糖体数据库项目(RDP, http://rdp.cme.msu.edu/misc/resources.jsp)、国家生物技术信息中心(NCBI,http://ncbi.nlm.nih.gov/)数据库等分析原始DNA数据的生物信息,将获得的DNA读数聚集到具有97% 相似性的操作分类单元(Operational taxonomic unit,OTU)。
3. 结果和讨论
3.1 热储环境特征
林甸地热田地热流体主要赋存于白垩系姚家组、青山口组和泉头组热储中。地热井井深一般约1800~2000 m,最深3000 m(LSR1)。热水井口温度为48~68℃,pH为7.95~8.93,TDS为1409~4705 mg/L,TOC为235.8~477.1 mg/L,13CDIC为-12.11‰~-8.07‰VPDB。其中,LR45井TDS最高,为4705 mg/L,TOC最低,为235.8 mg/L, 13CDIC最为富集,为-4.33‰VPDB,热水离子以Cl、HCO3-和Na为主,其中LR7、LR45和LR60的水化学类型为Cl·HCO3-Na型,其余为HCO3·Cl-Na型。(表 1)。
表 1 采样井井深和热水水化学特征Table 1. Depth of sampling wells and thermal water chemistry
3.2 微生物多样性分析
微生物多样性采用Alpha多样性与Beta多样性表征。其中,Alpha多样性系指某一特定区域或生态系统内的微生物多样性,可用一系列指数来衡量,如使用Sobs、Chao与ACE指数衡量微生物种类丰富度,用Shannon和Simpson指数衡量群落分布多样性,用Shannoneven指数计算群落分布均匀度;Beta多样性是指不同生态系统之间多样性的比较,是物种组成沿环境因子梯度或在群落间的变化率,可用来表示不同样品间的物种丰度分布差异程度,可用Bray-Curtis距离来度量,计算公式为:

式中,d代表样品间的Bray-Curtis距离;xi与yi分别代表两不同样品中i组分的丰度。
3.2.1 细菌多样性分析
生物统计学分析结果显示,所有样品的群落覆盖率(Coverage)均大于99%,表明测序结果可代表样品微生物的组成。微生物多样性指数显示,供暖季热水样品中细菌的Sobs、Chao和ACE指数明显低于非供暖季样品,除LR10外,供暖季样品中微生物种类数约为非供暖季样品的1/2(表 2);衡量群落分布多样性的Shannon、Simpson和Shannoneven指数同样呈现明显的季节差异,除LR10样品外,供暖季样品Shannon和Shannoneven指数远小于非供暖季样品,而Simpson指数远大于非供暖季样品(表 2),表明非供暖季样品的细菌种类数与细菌群落多样性均高于供暖季样品,且细菌数目在群落中的均匀分配程度更高。但供暖季样品中LR10的细菌种类数与群落多样性远高于其他样品,Sobs、Chao与ACE指数约为同时期采集的4个供暖季样品的3倍、非供暖季样品的1.5倍,Shannon、Simpson与Shannoneven指数基本与非供暖季样品相同,表明LR10样品中细菌种类数与群落多样性远比其他样品高。
表 2 样品中细菌群落多样性指标Table 2. Diversity indices of bacterial communities in the investigated water samples
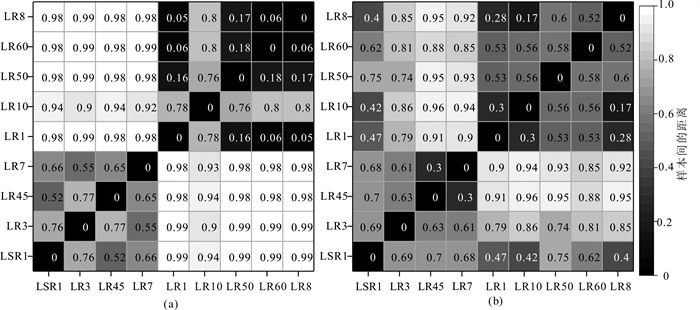
基于Bray-Curtis算法的细菌属水平上样品间距离显示,供暖季与非供暖季样品的差异显著,Bray-Curtis距离均在0.9以上,部分样品间高达0.99,表明供暖季与非供暖季地热水中的微生物群落结构差异较大;供暖季样品之间,LR10与其余样品的差异较大,Bray-Curtis距离均为0.8左右,而LR10以外的供暖季样品之间则较为相似,Bray-Curtis距离仅为0.06~0.18,;非供暖季样品间的差异较大,Bray-Curtis距离为0.55~0.77(图 2a)。
综上,林甸地热田热水微生物多样性呈明显的季节变化,推测其原因有二:一是地热井为混层开采,供暖季热水开采间不同深度地热水贡献的水量不同;二是供暖季井周热水流动快,微生物因水流和水化学扰动而无法富集,热水中微生物种类数和群落数减少,而非供暖季热水流动慢,利于微生物的增殖与富集,热水中微生物多样性更高。
3.2.2 古菌多样性分析
利用RDP 16S数据库等古菌数据库筛选出各样品中的古菌进行多样性分析,结果表明其不存在显著的季节变化,也即基本不受热水开采的影响。从Sobs、Chao与ACE指数来看,LR50的古菌种类数最多,而LR1最少,其余样品基本相同;从Shannon、Simpson和Shannoneven指数来看,LR50的Shannon指数最高而Simpson指数最低,LR7的Shannon指数最低而Simpson指数最高,表明LR50古菌群落多样性最高而LR7最低(表 3)。
表 3 调查样品中古菌群落多样性指标Table 3. Diversity indices of Archaeal communities in the investigated water samples
古菌属水平上样品间距离显示,供暖季与非供暖季样品不存在显著差异(图 2b),LR1、LR8与LR10样品之间的差异性较低,表明三组样品之间可能存在水力联系。LR7与LR45与其他样品的差异性较高,距离均在0.9以上,这与LR7与LR45样品与其他距离较远,水力联系较差,地热水环境条件差异性大有关。
3.3 微生物群落结构
3.3.1 细菌
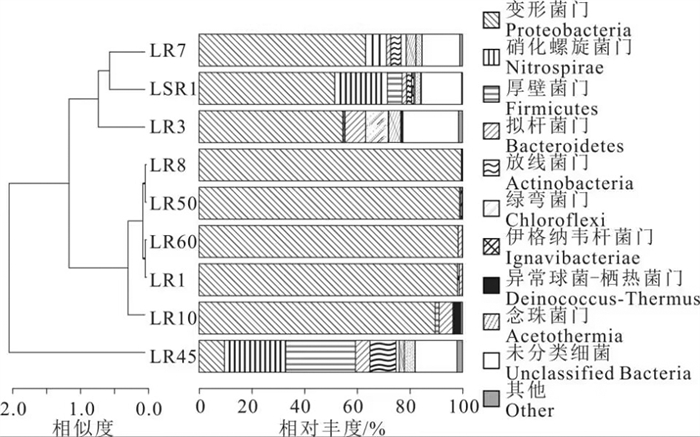
门水平上各样品细菌物种组成和丰度显示,不同样品细菌的群落结构存在较大差异(图 3)。供暖季的5个样品中,除LR10外,LR1、LR8、LR50和LR60中主要优势细菌为变形菌门(Proteobacteria, > 98%)、γ-变形菌纲(Gammaproteobacteria, > 90%)、α-变形菌纲(Alphaproteobacteria, 2.6%~5.6%),β-变形菌纲(Betaproteobacteria, 0.5%~1.8%),假单胞菌目(Pseudomonadales, > 90%);在科和属水平上,LR50优势细菌为莫拉氏菌科(Moraxellaceae, 80.00%)、不动杆菌属(Acinetobacter, > 80.00%)和假单胞菌科(Pseudomonadaceae, 11.10%)、假单胞菌属(Pseudomonas, 11.10%);LR1、LR60和LR8为莫拉氏菌科(Moraxellaceae, > 92%),不动杆菌属(Acinetobacter, > 92%);而LR10样品主要优势细菌除变形菌门(Proteobacteria, 89.62%)外,还有拟杆菌门(Bacteroidetes, 5.52%)与厚壁菌门(Firmicutes, 1.47%),不同于其他样品中α-变形菌纲占绝对优势,LR10中α-变形菌纲(Alphaproteobacteria, 46.57%)、γ-变形菌纲(Gammaproteobacteria, 23.24%)和β-变形菌纲(Betaproteobacteria, 19.71%)均占较大比例,且目、科和属水平优势细菌更丰富。在目水平上主要有四种优势细菌,分别为鞘氨醇单胞菌目(Sphingomonadales, 35.94%)、假单胞菌目(Pseudomonadales, 18.90%)、伯克氏菌目(Burkholderiales, 15.23%)和根瘤菌目(Rhizobiales, 7.84%),而在科和属水平有9种细菌相对丰度高于2%,其中丰度最高的两种分别为鞘氨醇单胞菌科(Sphingomonadaceae, 35.92%)、新鞘氨醇杆菌属(Novosphingobium, 35.76%)和莫拉氏菌科(Moraxellaceae, 18.52%)、不动杆菌属(Acinetobacter, 18.51%)。
非供暖季的4个样品中的优势细菌与供暖季样品存在显著差异,优势细菌更为丰富。在门水平上,变形菌门(Proteobacteria)、硝化螺旋菌门(Nitrospirae)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobcteriae)、绿弯菌门(Chloroflexi)、伊格纳韦杆菌门(Ignavibacteriae)和念珠菌门(Acetothermia)均占有较高比例(相对丰度 > 1%)。其中LSR1、LR3和LR7中变形菌门(Proteobacteria)占优势,相对丰度大于50%,又以LR7样品最高,相对丰度为63.23%;LR45以硝化螺旋菌门(Nitrospirae)、厚壁菌门(Firmicutes)丰度最高,相对丰度分别为23.11%和26.63%。在纲水平上,4个样品中占据最大优势的细菌各有不同,其中LSR1为δ-变形菌纲(Deltaproteobacteria, 45.39%),LR3和LR7样品均为为γ-变形菌纲(Gammaproteobacteria)和β-变形菌纲(Betaproteobacteria),相对丰度分别为23.66%、34.82%和34.82%、21.66%,LR45样品为硝化螺旋菌纲(Nitrospira, 23.11%)和梭菌纲(Clostridia, 25.72%)。非供暖季样品纲以下水平的检测结果中未分类的细菌占比较高,此处不做详细分析。
已有研究中,诸多地热田热水微生物变形菌门并不占优势。例如,雄安新区深部岩溶-裂隙热储层细菌门以厚壁菌门和变形菌门为主,占比分别为38.70%和37.61%(赵佳怡, 2020),美国黄石公园的Coffee pot热泉(水温39~74℃,pH 5.8~6.9)、Obsidian pool热泉(水温74℃,pH 6.7~7.6)等高温热泉主要以放线菌门(Actinobacteria)和产水菌门(Aquificae)为优势菌群,印尼酸性温泉中细菌以厚壁菌门和γ-变形菌纲为主(沈继红等,2012)。不动杆菌属和假单胞菌属在油藏中大量存在,是目前已知的具有烃降解能力的属(Davidova et al., 2007),均为好氧嗜中温细菌,在其他油藏中也曾发现不动杆菌属和假单胞菌属的存在(佘跃惠等,2005;余跃惠,2010),但在大庆油田以不动杆菌属为优势类群(艾明强等, 2010)。林甸地热田热水中微生物群落结构与油田更为相似,这应与林甸地热田地层中有机物含量较高有关。
3.3.2 古菌
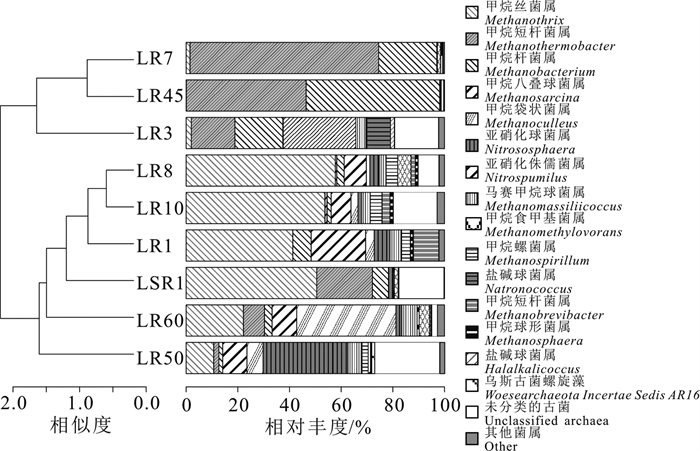
所有样品中古菌群落主要由广古菌门(Euryarchaeota)、奇古菌门(Thaumarchaeota)、泉古菌门(Crenarchaeota)和乌斯古菌门(Woesearchaeota)组成。在属水平上,LSR1的优势古菌为甲烷丝菌属(Methanothrix, 50.53%)、甲烷短杆菌属(Methanothermobacter, 21.58%)和甲烷杆菌属(Methanobacterium, 6.17%);LR45和LR7为甲烷短杆菌属(Methanothermobacter)和甲烷杆菌属(Methanobacterium),其相对丰度分别为46.39%、51.74%和73.02%、22.55%;LR3中这两属亦占较大比例,相对丰度大于15%,但以亚硝化侏儒菌属(Nitrosopumilus)占比最大,相对丰度达28.04%。LR1、LR10和LR8的优势古菌为甲烷丝菌属(Methanothrix)和甲烷八叠球菌属(Methanosarcina);LR50为亚硝化单胞菌属(Nitrososphaera, 32.89%)和甲烷丝菌属(Methanothrix, 10.68%);LR60为甲烷袋状菌属(Nitrososphaera, 38.42%)和甲烷丝菌属(Methanothrix, 22.17%)(图 4)。
3.4 产甲烷机制
前文分析表明,产甲烷菌在林甸地热田古菌群落中占主导地位,指示地下水处于极度还原环境。目前认为产甲烷菌存在3种产甲烷代谢方式(张坚超等,2018;任秘坊等,2020),分别为CO2还原途径:主要为H2或甲酸还原CO2产生甲烷;乙酸裂解途径:乙酸先被裂解形成甲基和羧基,羧基被氧化产生H2来还原甲基形成甲烷;甲基产甲烷途径:该途径可分为两种,一种为以H2氧化甲基化合物产生甲烷,另一种为甲基化合物发生歧化作用产生甲烷(Russell and Martin, 2004;李先奇等, 2005;Ferry et al., 2007;Rother, 2010;蒋娜等, 2013;Lü et al., 2018;段昌海等,2019;冷欢等,2020)。林甸地热田热水的古菌中,甲烷短杆菌属(Methanobrevibacter)、甲烷杆菌属(Methanobacterium)、甲烷袋状菌属(Methanoculleus)和甲烷球形菌属(Methanosphaera)以H2还原CO2途径为能量来源(McBride and Wolfe, 1971;Zeikus and Wolee, 1972;Miller,2016;Boone,2016;Lai, 2019;Shao et al., 2020);甲烷八叠球菌属(Methanosarcina)和甲烷丝菌属(Methanothrix)以乙酸裂解途径为能量来源(Zinder et al., 1984;Jetten et al., 1992;Wagner,2020;Akinyemi et al., 2020);马赛甲烷球菌属(Methanomassiliicoccus)以甲基产甲烷作用为能量来源(Nkamga et al., 2016)。
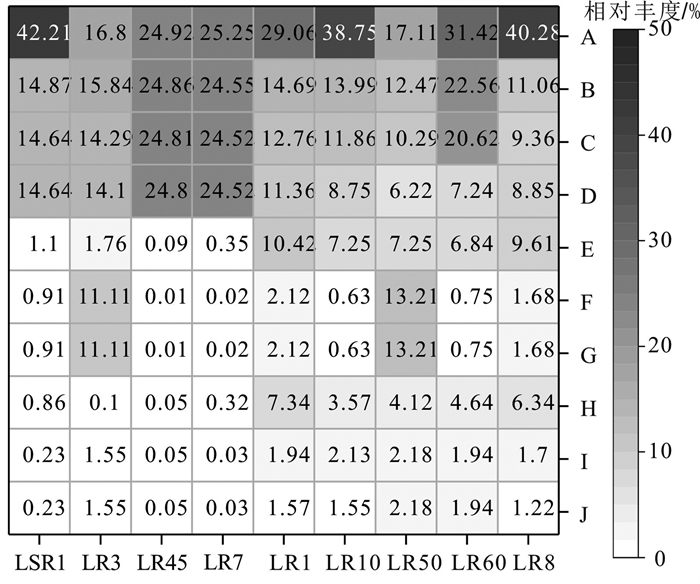
基于FAPROTAX数据库(http://fungene.cme.msu.edu/),古菌功能基因预测(Parks et al., 2014; 樊萌萌,2016;张淼,2020),结果显示(图 5)所有样品中,与产甲烷作用直接相关的功能基因占比最高,相对丰度为16.80%~42.21%,其中LSR1和LR8样品相对丰度高于40%,表明在林甸地热田中,地热流体中的甲烷气体主要来自产甲烷古菌的代谢作用。其中,与氢营养型产甲烷作用有关的功能基因占比也较高,其相对丰度为11.06%~24.86%,为主要的产甲烷途径,而与甲基歧化产甲烷作用和H2还原甲基化合物产甲烷作用有关的功能基因虽占有一定比例,但相对丰度较低(相对丰度为0.03%~7.34%),表明其为次要的产甲烷途径。
![]() 图 5 古菌群落功能预测相对丰度热图A—产甲烷作用;B—氢气产甲烷作用;C—氢气还原二氧化碳产甲烷作用;D—暗氢氧化作用;E—化学异养作用;F—硝化作用;G—厌氧氨氧化;H—甲基歧化反应产甲烷作用;I—氢气还原甲基产甲烷作用;J—甲基营养型产甲烷作用Figure 5. Heatmap of relative abundances of predicted archaeal community functionA-Methanogenesis; B-Hydrogenotrophic methanogenesis; C-Methanogenesis by CO2 reduction with H2; D-Dark hydrogen oxidation; E-Chemoheterotrophy; F-Nitrification; G-Aerobic ammonia oxidation; H-Methanogennesis by disproportionation of methyl groups; I-Methanogennesis by reduction of methyl compounds with H2; J-Methanogenesis by methylotrophy
图 5 古菌群落功能预测相对丰度热图A—产甲烷作用;B—氢气产甲烷作用;C—氢气还原二氧化碳产甲烷作用;D—暗氢氧化作用;E—化学异养作用;F—硝化作用;G—厌氧氨氧化;H—甲基歧化反应产甲烷作用;I—氢气还原甲基产甲烷作用;J—甲基营养型产甲烷作用Figure 5. Heatmap of relative abundances of predicted archaeal community functionA-Methanogenesis; B-Hydrogenotrophic methanogenesis; C-Methanogenesis by CO2 reduction with H2; D-Dark hydrogen oxidation; E-Chemoheterotrophy; F-Nitrification; G-Aerobic ammonia oxidation; H-Methanogennesis by disproportionation of methyl groups; I-Methanogennesis by reduction of methyl compounds with H2; J-Methanogenesis by methylotrophy4. 结论
本文通过对林甸地热田9口地热井供暖季和非供暖季两期微生物样品的采集、测试,及微生物多样性和群落结构分析,得到以下主要结论:
(1)林甸地热田热水微生物多样性受热水开采扰动影响而发生显著变化。非供暖季热水中细菌种类数与群落多样性均高于供暖季,而古菌多样性基本不受开采阶段的影响。
(2)热水中优势细菌主要为α-变形菌纲、β-变形菌纲和γ-变形菌纲,且大部分样品的优势菌属为不动杆菌属(Acinetobacter, > 80%),与已报道的地热系统有一定不同,但与油田系统较为相似。
(3)古菌主要以广古菌门产甲烷菌为主,产甲烷菌的存在表明地热储层存在强烈的还原性地下水环境;古菌功能基因预测结果表明,林甸地热田甲烷气体主要源于氢营养型产甲烷途径,而甲基歧化产甲烷作用和H2还原甲基化合物产甲烷途径次之。
致谢: 感谢现场调查过程中林甸县地热资源开发利用办公室的大力支持。 -
图 5 古菌群落功能预测相对丰度热图
A—产甲烷作用;B—氢气产甲烷作用;C—氢气还原二氧化碳产甲烷作用;D—暗氢氧化作用;E—化学异养作用;F—硝化作用;G—厌氧氨氧化;H—甲基歧化反应产甲烷作用;I—氢气还原甲基产甲烷作用;J—甲基营养型产甲烷作用
Figure 5. Heatmap of relative abundances of predicted archaeal community function
A-Methanogenesis; B-Hydrogenotrophic methanogenesis; C-Methanogenesis by CO2 reduction with H2; D-Dark hydrogen oxidation; E-Chemoheterotrophy; F-Nitrification; G-Aerobic ammonia oxidation; H-Methanogennesis by disproportionation of methyl groups; I-Methanogennesis by reduction of methyl compounds with H2; J-Methanogenesis by methylotrophy
表 1 采样井井深和热水水化学特征
Table 1 Depth of sampling wells and thermal water chemistry

表 2 样品中细菌群落多样性指标
Table 2 Diversity indices of bacterial communities in the investigated water samples

表 3 调查样品中古菌群落多样性指标
Table 3 Diversity indices of Archaeal communities in the investigated water samples

-
Aditiawati P, Yohandini H, Madayanti F, Akhmaloka. 2009. Microbial diversity of acidic hot spring (KawahHujan B) in geothermal field of KamojangArea, West Java-Indonesia[J]. The Open Microbiology Journal, 3: 58-66. doi: 10.2174/1874285800903010058
Ai Mingqiang, Li Hui, Liu Xiaobo, Shi Rongjiu, Hang Siqin, Li Nana, Zhang Yin. 2010. Bacterial community structure in production water from oil reservoirs in Daqing Oilfield[J]. Chinese Journal of Applled Ecology, 21(4): 1014-1020(in Chinese with English abstract).
Akinyemi T S, Shao N, Whitman W B. 2020. Methanothrix. Bergey's Manual of Systematics of Archaea and Bacteria[M]. American Cancer Society.
Blank C E, Cady S L, Pace N R. 2002. Microbial composition of near-boiling silica-depositing thermal springs throughout Yellowstone National Park[J]. Applied and Environmental Microbiology, 68(10): 5123-5135. doi: 10.1128/AEM.68.10.5123-5135.2002
Boone D R. 2016. Methanobacterium. Bergey's Manual of Systematics of Archaea and Bacteria[M]. American Cancer Society.
Cheng Rihui, Zhu Defeng, Wang Hongyan, Wang Pujun. 2006. Primary geochemical characteristics and geochemical characteristics of the paleogeography in the Linglong Fault Sag, Songliao Basin[J]. Journal of Jilin University, 36(5): 793-798 (in Chinese with English abstract). doi: 10.3969/j.issn.1671-5497.2006.05.033
Davidova I A, Gieg L M, Duncan K E, Suflita J M. 2007. Anaerobic phenanthrene mineralization by a carboxylating sulfate-reducing bacterial enrichment[J]. Isme Journal, 1(5): 436-442. doi: 10.1038/ismej.2007.48
Ding Anna, Song Guixia, Hui Rongyao, Lu Shuangfang. 2004. Distribution and geochemical significance of acidic oxygen-containing compounds in biogas source rocks in Binbei area, Songliao Basin[J]. Natural Gas Geoscience, 15(1): 51-57 (in Chinese with English abstract). doi: 10.3969/j.issn.1672-1926.2004.01.010
Dong Junlin. 2013. Evaluation on Geothermal Resource Potential in Changqinglinchang[D]. Changchun: Jilin University, 1-57(in Chinese with English abstract).
Duan Changhai, Zhang Cuijing, Sun Yihua, Li Meng. 2019. Recent advances on the novel methanogens[J]. Acta Microbiologica Sinica, 51(6): 981-995 (in Chinese with English abstract).
Fan Mengmeng. 2016. Comparative Metagenomic Analysis of Microbial Communities in Geothermal Environments with Different Temperatures and pH Values[D]. Beijing: University of Chinese Academy of Sciences, 1-123 (in Chinese with English abstract).
Ferry J G, Kastead K A. 2007. Methanogenesis[M]. Archaea: Molecular and Cellular Biology, ed CavicchioliR (ASM Press, Washington, DC), 288-314.
Jetten M S M, Stams A J M, Zehnder A J B. 1992. Methanogenesis from acetate: A comparison of the acetate metabolism in Methanothrixsoehngenii and Methanosarcina spp. [J]. FEMS Microbiology Letters, 8(3/4): 181-197.
Jiang Na, Chen Zijuan, Cao Yi, Tian Jianqing, Wang Yanfen, Dong Xiuzhu, Dong Xiuzhu. 2013. Methanogen archaea and its mediated methane production pathway in cryogenic wetlands[J]. Microbiology Bulletin, 40(1): 137-145 (in Chinese with English abstract).
Jiang Zhou. 2016. Environmental Biogeochemistry of Arsenic in Tengchong Geothermal Area[D]. Wuhan: China University of Geosciences, 1-109 (in Chinese with English abstract).
Kristjánsson J K, Hreggvidsson G O. 1995. Ecology and habitats of extremophiles[J]. World Journal of Microbiology & Biotechnology, 11: 17-25.
Lai M C. 2019. Methanoculleus. Bergey's Manual of Systematics of Archaea and Bacteria[M]. American Cancer Society.
Lü Z, Shao N, Akinyemi T, Whitman, W B. 2018. Methanogenesis[J]. Current Biology, 28(13): 727-732. doi: 10.1016/j.cub.2018.05.021
Leng Huan, Yang Qin, Huang Gangfeng, Bai Liping. 2020. Recent advances in hydrogenotrophic methanogenesis[J]. Acta Microbiologica Sinica, 60(10): 2136-2160 (in Chinese with English abstract).
Li Xianqi, Zhang Shuichang, Zhu Guangyou, Liang Yinbo. 2005. Classification and research direction of biogenic gas in China[J]. Natural Gas Geology, 16(4): 478-483(in Chinese with English abstract).
McBride B C, Wolfe R S. 1971. Biosynthesis of dimethylarsine by Methanobacterium[J]. Biochemistry, 10(23): 4312-4317. doi: 10.1021/bi00799a024
Meng Yuchen. 2018. Diversity of Bacterial Community Structure and Taxonomy of New Species in Oil Reservoir[D]. Guiyang: Guizhou Medical University, 1-56 (in Chinese with English abstract).
Miller T L. 2016. Methanobrevibacter. Bergey's Manual of Systematics of Archaea and Bacteria[M]. American Cancer Society.
Nkamga V D, Drancourt M, Michel D. 2016. Methanomassiliicoccus. Bergey's Manual of Systematics of Archaea and Bacteria [M]. American Cancer Society.
Parks D H, Tyson G W, Hugenholtz P, Beiko R G. 2014. STAMP: Statistical analysis of taxonomic and functional profiles[J]. Bioinformatics, 30(21): 3123-3124. doi: 10.1093/bioinformatics/btu494
Russell M J, Martin W. 2004. The rocky roots of the acetyl-CoA pathway[J]. Trends in Biochemical Sciences, 29(7): 358-363. doi: 10.1016/j.tibs.2004.05.007
Ren Mifang, Li Lingyan, Chen Lin, Xing Tingting, Liu Yongqin, Dong Xiuzhu. 2000. Analysis of methanogenic bacteria and methanogenic metabolic pathway in three saline-alkali lakes on Qinghai-Tibet Plateau[J]. Acta Microbiologica Sinica, 60(1): 161-171(in Chinese with English abstract).
Reysenbach A L, Shock E. 2002. Merging genomes with geochemistry in hydrothermal ecosystems[J]. Science, 296(5570): 1077-1082. doi: 10.1126/science.1072483
Rother M. 2010. Methanogenesis. Handbook of Hydrocarbon and Lipid Microbiology[M]. Springer Berlin Heidelberg.
Shao N, Akinyemi T S, Whitman W B. 2020. Methanosphaer. Bergey's Manual of Systematics of Archaea and Bacteria[M]. American Cancer Society.
She Yuehui, Zhang Xueli, Zhang Fan, Wnag Linghua, Zhao Liping. 2005. Molecular analysis of microbial community in water drive reservoir of Dagangkongdian oilfield[J]. Acta Microbiologica Sinica, 3: 329-334 (in Chinese with English abstract).
She Yuehui. 2010. Study on the Mechanism of Enhancing Oil Recovery by Microbial Resources[D]. Wuhan: Wuhan University, 1-151 (in Chinese with English abstract).
Shen Jihong, Song Weizhi, Lin Xuezheng, Wang Shuai, Dewi Seswita Zilda. 2012. Analysis of archaea diversity in Padang Cermin thermal spring, Indonesia[J]. Progress in Marine Science, 30(4): 534-540(in Chinese with English abstract).
Song Zhaoqi, Chen Jingquan, Zhi Xiaoyang, Haung Zhiyong, Zhang Chuanlun, Li Wenjun. 2008. Crenarchaeal diversity and phylogenetic analysis of two hot springs in Tengchong[J]. Microbiology China, 35 (3): 372-377(in Chinese with English abstract).
Song Zhaoqi, Wang Li, Liu Xiuhua, Liang Feng. 2015. Bacterial diversity of Proteobacteria from four acidic hot springs in Yunnan Province[J]. Journal of Henan Agricultural University, (3): 376-382(in Chinese with English abstract).
Sun Xiaoxi, Jiang Hongchen. 2020. Research progress in the nitrification process of lake microorganisms[J]. Journal of Microbiology, 60(6): 1148-1161(in Chinese with English abstract).
Wagner D. 2020. Methanosarcina. Bergey's Manual of Systematics of Archaea and Bacteria[M]. American Cancer Society.
Wang Jie. 2017. Enrichment Conditions and Resource Potential of Water-Soluble Gas in Northern Songliao Basin[D]. Daqing: Northeast Petroleum University, 1-61 (in Chinese with English abstract).
Wang Wanchun, Tao Mingxin. 2005. Geomicrobial interaction and petroleum resources[J]. Geological Bulletin of China, 24(10/11): 1022-1026 (in Chinese with English abstract).
Zeikus J G, Wolee R S. 1972. Methanobacterium thermoautotrophicus sp. n., an anaerobic, autotrophic, extreme thermophile[J]. Journal of Bacteriology, 109(2): 707-713. doi: 10.1128/jb.109.2.707-713.1972
Zhang Daokuo. 2009. Accumulation Conditions and Potential of Water-soluble Gas Resources in Lindian Area of Songliao Basin[D]. Changchun: Jilin University, 1-52 (in Chinese with English abstract).
Zhang Gongcheng, Qu Hongjun, Zhang Fenglian, Chen Shuo, Yang Haichang, Zhao Chuan, Zhao Chong. 2019. New discoveries and implications of global deepwater oil and gas[J]. Acta PetroleiSinica, 40(1): 1-34, 55 (in Chinese with English abstract).
Zhang Jianchao, Xu Yiqin, Lu Yahai. 2015. Microbial mechanism of methane production and oxidation in terrestrial ecosystem[J]. Acta Ecologica Sinica, 35(20): 6592-6603 (in Chinese with English abstract).
Zhang Linye, Liu Qing, Zhang Chunrong. 2005. Study on the Relationship between Hydrocarbon Generation and Hydrocarbon Accumulation in Dongying Sag[M]. Beijing: Geological Publishing House(in Chinese with English abstract).
Zhang L, Sun Z, Geng W, Cao H, Qin Y, Xu C, Zhang X, Li X, Zhang X, Song H. 2019. Advances in the microbial mineralization of seafloor hydrothermal systems[J]. China Geology, 2(2): 227-237. doi: 10.31035/cg2018087
Zhang Miao. 2020. Metagenomic Study on the Structure and Function of Microbial Communities in Sediments and Deep Groundwater of the High Arsenic Aquifer in Yinchuan[D]. Harbin: Harbin Institute of Technology, 1-75(in Chinese with English abstract).
Zhang Wei, Hu Xiaoli, Qiu Xuan, Liu Deng, Feng Liang, Ma Liyuan, Hu Jing, Wang Hongmei. 2019. Microbiome characteristics of Zhan 3 reservoir in Shengli Oilfield, Shandong Province[J]. Science China (Earth Sciences), 64(18): 1930-1942(in Chinese with English abstract).
Zhao Jiayi. 2020. Study on Spatial Structure and Hydrothermal Differentiation Process of Deep Heat Storage in Xiongan New Area[D]. Beijing: Chinese Academy of Geological Sciences, 1-151 (in Chinese with English abstract).
Zinder S H, Cardwell S C, Anguish T, Lee M, Koch M. 1984. Methanogenesis in a Thermophilic (58℃) Anaerobic Digestor: Methanothrix sp. as an Important Aceticlastic Methanogen[J]. Appllied Environmental Microbiology, 47(4): 796-807. doi: 10.1128/aem.47.4.796-807.1984
艾明强, 李慧, 刘晓波, 史荣久, 韩斯琴, 李娜娜, 张颖. 2010. 大庆油田油藏采出水的细菌群落结构[J]. 应用生态学报, 21(4): 1014-1020. 程日辉, 朱德丰, 王洪艳, 王璞珺. 2006. 松辽盆地林甸断陷白垩纪沙河子期盆地次级构造单元与沉积体系[J]. 吉林大学学报, 36(5): 793-798. 董俊领. 2013. 长青林场地热资源潜力评价[D]. 长春: 吉林大学, 1-57. 段昌海, 张翠景, 孙艺华, 李猛. 2019. 新型产甲烷古菌研究进展[J]. 微生物学报, 51(6): 981-995. 丁安娜, 宋桂侠, 惠荣耀, 卢双舫. 2004. 松辽盆地滨北地区生物气源岩酸性含氧化合物的分布及其地球化学意义[J]. 天然气地球科学, 15(1): 51-57. 樊萌萌. 2016. 不同温度和pH值地热环境下微生物群落的比较宏基因组学分析[D]. 北京: 中国科学院大学, 1-123. 姜舟. 2016. 腾冲地热区砷的环境生物地球化学研究[D]. 武汉: 中国地质大学, 1-109. 蒋娜, 陈紫娟, 曹轶, 田建卿, 王艳芬, 东秀珠. 2013. 低温湿地甲烷古菌及其介导的甲烷产生途径[J]. 微生物学通报, 40(1): 137-145. 冷欢, 杨清, 黄钢锋, 白丽萍. 2020. 氢营养型产甲烷代谢途径研究进展[J]. 微生物学报, 60(10): 2136-2160. 李先奇, 张水昌, 朱光有, 梁英波. 2005. 中国生物成因气的类型划分与研究方向[J]. 天然气地质学, 16(4): 478-483. 孟俞辰. 2018. 油藏细菌群落结构多样性及新种系统分类学研究[D]. 贵阳: 贵州医科大学, 1-56. 任秘坊, 李凌燕, 陈琳, 邢婷婷, 刘勇勤, 东秀珠. 2020. 青藏高原三个盐碱湖的产甲烷菌群和产甲烷代谢途径分析[J]. 微生物学报, 60(1): 11. 佘跃惠, 张学礼, 张凡, 王凌华, 赵立平. 2005. 大港孔店油田水驱油藏微生物群落的分子分析[J]. 微生物学报, 3: 329-334. 佘跃惠. 2010. 油藏微生物资源提高原油采收率机理研究[D]. 武汉: 武汉大学, 1-151. 沈继红, 宋维志, 林学政, 王帅, Dewi Seswita Zilda. 2012. 印度尼西亚Padang Cermin热泉古菌多样性分析[J]. 海洋科学进展, 30(4): 534-540. 宋兆齐, 陈经全, 职晓阳, 黄志勇, 张传伦, 李文均. 2008. 腾冲两热泉泉古菌多样性及系统发育的初步分析[J]. 微生物学通报, 35(3): 372-377. 宋兆齐, 王莉, 刘秀花, 梁峰. 2015. 云南4处酸性热泉中的变形菌门细菌多样性[J]. 河南农业大学学报, 50(3): 376-382. 孙小溪, 蒋宏忱. 2020. 湖泊微生物硝化过程研究进展[J]. 微生物学报, 60(6): 1148-1161. 王杰. 2017. 松辽盆地北部水溶气富集条件及其资源潜力[D]. 大庆: 东北石油大学, 1-61. 王万春, 陶明信. 2005. 地质微生物作用与油气资源[J]. 地质通报, 24(10/11): 1022-1026. 张道阔. 2009. 松辽盆地林甸地区水溶气资源聚集条件及其潜力[D]. 长春: 吉林大学, 1-52. 张功成, 屈红军, 张凤廉, 陈硕, 杨海长, 赵钊, 赵冲. 2019. 全球深水油气重大新发现及启示[J]. 石油学报, 40(1): 1-34, 55. doi: 10.3969/j.issn.1001-8719.2019.01.001 张坚超, 徐镱钦, 陆雅海. 2018. 陆地生态系统甲烷产生和氧化过程的微生物机理[J]. 生态学报, 35(20): 6592-6603. 张林晔, 刘庆, 张春荣. 2005. 东营凹陷成烃与成藏关系研究[M]. 北京: 地质出版社. 张淼. 2020. 银川高砷含水层沉积物和深层地下水中微生物群落结构和功能的宏基因组学研究[D]. 哈尔滨: 哈尔滨工业大学, 1-75. 张蔚, 胡小丽, 邱轩, 刘邓, 冯亮, 马丽媛, 胡婧, 王红梅. 2019. 山东胜利油田沾3油藏微生物组特征[J]. 中国科学, 64(18): 1930-1942. 赵佳怡. 2020. 雄安新区深部热储空间结构与水热分异过程研究[D]. 北京: 中国地质科学院, 1-151.



 下载:
下载: