Carbon sink of soil inorganic carbon in arid regions and its contribution to carbon sequestration and emission reduction: A review
-
摘要:研究目的
干旱区土壤无机碳作为全球碳循环举足轻重的组成部分,其碳汇效应不容忽视。
研究方法本文查阅了大量国内外干旱区土壤无机碳的相关文献,重点对土壤无机碳汇确认、碳库组成、来源识别,以及碳汇影响因素进行了系统性归纳总结。
研究结果干旱区无机碳汇效应伴随着干旱区负通量研究得到确认,但其碳库组成十分复杂,包括了液相碳库与固相碳库。其中液相储库主要以可溶性碳酸盐形式赋存于干旱区地下水体;固相储库则为以固相碳酸盐矿物的形式赋存在土壤中,依据不同成因来源分为成岩碳酸盐与成土碳酸盐,后者又细分为碳质成土碳酸盐与硅质成土碳酸盐。成土碳酸盐中的硅质成土碳酸盐具备真正长期稳定的碳汇效应。无机碳汇的影响因素复杂,包括了自然的气候、土壤性质与深度、生物作用、成土母质、土壤有机质等因素,以及土地利用与土地覆盖、农业管理措施等人为因素。
结论干旱区土壤无机碳对全球碳循环研究极其重要,当前研究主要聚焦在土壤无机碳来源分辨,碳汇效应强度确认与固碳潜力量化,以及影响因素明确与人为干预的可能性评估等方面。在实现“双碳目标”驱动下,查清干旱—半干旱地区土壤无机碳源汇过程与影响因素必将是未来的研究热点,也是解决“碳失汇”科学难题的突破点,极大地推动全球碳循环研究。
创新点:(1)干旱区土壤无机碳碳库组成与碳汇效应是近几十年来研究热点,作为碳中和路线中人为固碳端的重要组成,缺乏系统和完善的综述文献,本文总结了土壤无机碳碳汇确认过程、碳库组成、来源识别方法,为干旱区土壤无机碳在全球碳循环中的碳汇作用与贡献研究提供参考;(2)本文梳理归纳了干旱区土壤无机碳碳汇作用及影响因素,为土壤无机碳实现人为调控固碳增汇打下理论基础,为调控的方向和强度提供参考。
Abstract:This paper is the result of environmental geological survey engineering.
ObjectiveAs a pivotal component of the global carbon cycle, the role of soil inorganic carbon in arid regions as a carbon sink cannot be ignored.
MethodsThis paper reviewed a large amount of literature related to soil inorganic carbon in arid regions at home and abroad, and focused on the confirmation of soil inorganic carbon carbon sink, carbon pool composition, source identification, and carbon sink influencing factors in a systematic summary.
ResultsThe role of inorganic carbon carbon sinks in arid regions was confirmed along with the study of negative fluxes in arid regions, but the composition of its carbon pool is very complex, including liquid−phase carbon pools and solid−phase carbon pools. The liquid−phase reservoir is mainly in the form of Dissolved Inorganic Carbon in the groundwater of the arid regions; the solid−phase reservoir is the solid−phase Soil Inorganic Carbon in the soil profile, which is divided into Lithogenic Carbonate and Pedogenic Carbonate according to different genetic sources, and the latter is subdivided into carbonaceous soil−forming carbonate and silicic soil−forming carbonate . The SPC in PC has a real long−term stable carbon sink. The factors influencing inorganic carbon sinks are complex, including natural factors: climate, soil properties and depth, biological effects, soil−forming parent material, soil organic matter, etc.; anthropogenic factors: land use and land cover, agricultural management measures (irrigation and fertilization), etc.
ConclusionsSoil inorganic carbon in drylands is extremely important for global carbon sequestration, and current research focuses on the identification of soil inorganic carbon sources, confirmation of carbon sink strength and quantification of carbon sequestration potential, as well as the clarification of influencing factors and assessment of the possibility of human intervention. Driven by the goal of achieving carbon peaking and carbon neutrality goals, the identification of soil inorganic carbon sources and influencing factors will be a research hotspot in the future within the global region, especially in arid and semi−arid regions. It will be a breakthrough point to solve the scientific problem of "Missing carbon sink", which will greatly promote the research of Global Carbon Cycle.
Highlights:(1) The composition of soil inorganic carbon pool and the role of carbon sink in arid regions is an international research hotspot in recent decades. As an important component of the anthropogenic carbon sequestration end of the carbon neutral route, there is a lack of systematic and complete review literature about this. This paper summarizes the carbon sink confirmation process, carbon pool composition, source identification methods, to provide a reference for studying the role and contribution of soil inorganic carbon in the global carbon cycle in drylands. (2) This paper composes and summarizes the carbon carbon sink role and the influencing factors of soil inorganic carbon in arid regions, and lays a theoretical foundation for soil inorganic carbon to achieve anthropogenic regulation of carbon sequestration and sink enhancement, and provides reference for the direction and intensity of regulation.
-
1. 引 言
碳循环是地球上最主要的生物地球化学循环,其变化深刻影响人类的生存(Schindler,1999)。20世纪90年代以来,由于应对大气温室气体触发的全球变暖危机,全球碳收支问题引起了科学家和公众的广泛关注。然而,在全球碳收支核算过程中,碳失汇问题( Missing carbon sink,约为 1.7 Pg C a−1) (Joos,1994;Bruce,1999)至今仍没有答案,各种研究与证据都指向了陆地碳库这一组成最复杂、估算最困难的碳库(Schindler,1999;Wofsy,2001;Wang and Hsieh,2002;方精云和郭兆迪,2007;Lal,2008)(图1)。
![]() Pg=1015g;人类通过化石燃料排放CO2进入大气的量约5.4 Pg C a−1,破坏森林排放进入大气的量约1.6 Pg C a−1,海洋吸收大气CO2的量约 2 Pg C a−1,大气CO2增加的量约3.3 Pg C a−1,这之间存在着−1.7 Pg C a−1的差值,即5.4 Pg +1.6 Pg −2 Pg −3.3 Pg =1.7 Pg,这部分CO2去向不明,故被称为碳失汇(据方精云和郭兆迪,2007)Figure 1. Schematic diagram of global carbon pool and missing carbon sink (modified from Lal, 2019; Naorem et al., 2022)Pg = 1015g; there is a difference of −1.7 Pg a−1 between human CO2 emissions into the atmosphere through fossil fuels of about 5.4 Pg a−1, forest destruction emissions into the atmosphere of about 1.6 Pg a−1, ocean absorption of atmospheric CO2 of about 2 Pg a−1, and increase in atmospheric CO2 of about 3.3 Pg a−1, which is 5.4 Pg + 1.6 Pg − 2 Pg −3.3 Pg =1.7 Pg, and this part of CO2 goes to an unknown destination, which is called missing carbon sink (modified from Fang Jingyun and Guo Zhaodi, 2007)
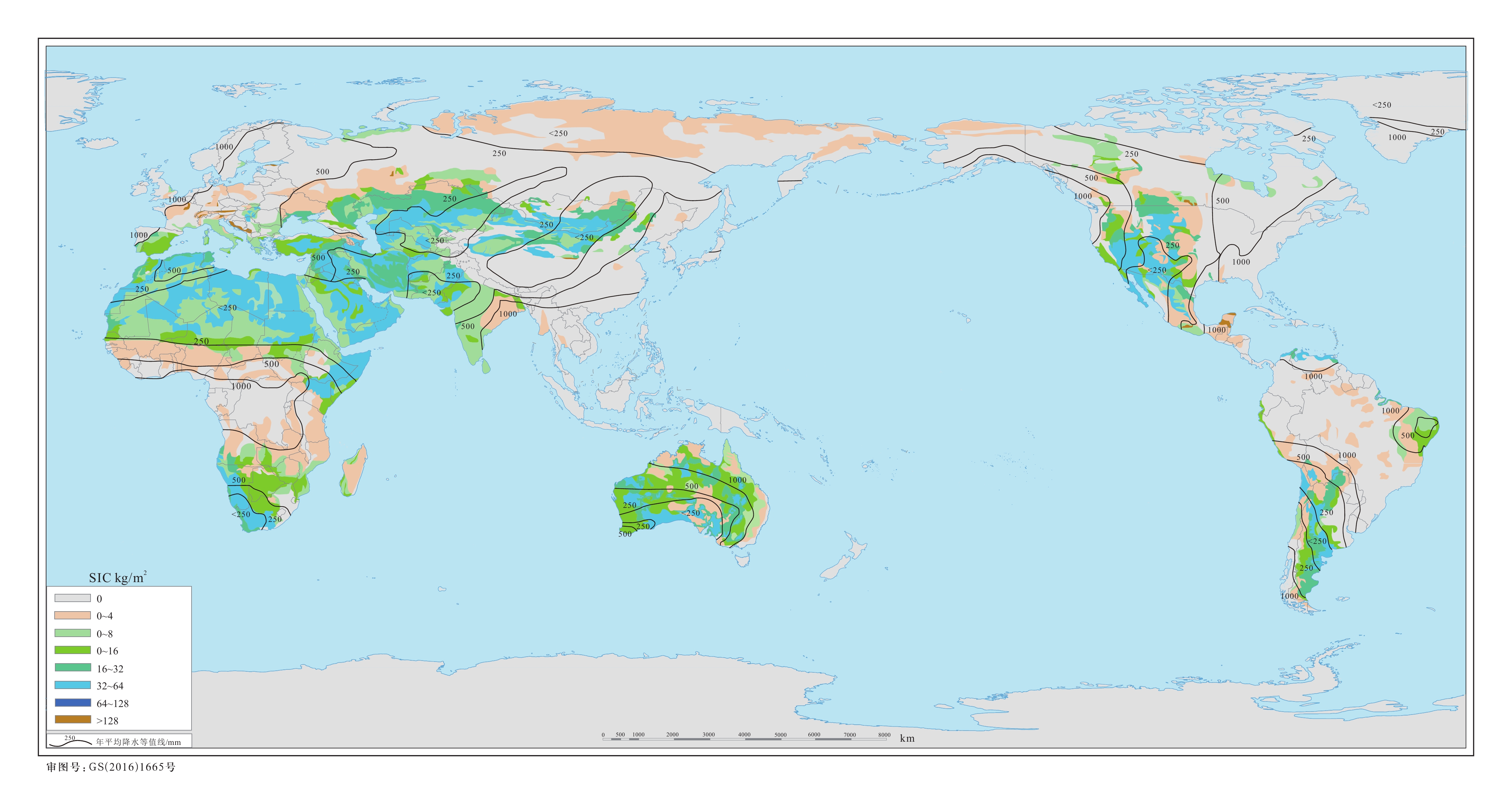
Pg=1015g;人类通过化石燃料排放CO2进入大气的量约5.4 Pg C a−1,破坏森林排放进入大气的量约1.6 Pg C a−1,海洋吸收大气CO2的量约 2 Pg C a−1,大气CO2增加的量约3.3 Pg C a−1,这之间存在着−1.7 Pg C a−1的差值,即5.4 Pg +1.6 Pg −2 Pg −3.3 Pg =1.7 Pg,这部分CO2去向不明,故被称为碳失汇(据方精云和郭兆迪,2007)Figure 1. Schematic diagram of global carbon pool and missing carbon sink (modified from Lal, 2019; Naorem et al., 2022)Pg = 1015g; there is a difference of −1.7 Pg a−1 between human CO2 emissions into the atmosphere through fossil fuels of about 5.4 Pg a−1, forest destruction emissions into the atmosphere of about 1.6 Pg a−1, ocean absorption of atmospheric CO2 of about 2 Pg a−1, and increase in atmospheric CO2 of about 3.3 Pg a−1, which is 5.4 Pg + 1.6 Pg − 2 Pg −3.3 Pg =1.7 Pg, and this part of CO2 goes to an unknown destination, which is called missing carbon sink (modified from Fang Jingyun and Guo Zhaodi, 2007)在地表碳库中,土壤是最大的陆地碳库,也是世界上第三大碳库,在碳循环过程中发挥重要作用。土壤碳库由土壤有机碳(Soil Organic Carbon,SOC)库与无机碳(Soil Inorganic Carbon,SIC)库组成。尽管土壤无机碳库储量在0~1 m深度的储量略低于土壤有机碳库,但多种方法估算结果显示其储量非常大:780 Pg C(Schlesinger,1982),930 Pg C(Schlesinger,1985),695~748 Pg C(Batjes,1996)和940 Pg C(Eswaran et al., 2000),超过了大气(760~880 Pg C)和陆生生物(540~610 Pg C)(Naorem et al., 2022;图1)碳库。更令人惊讶的是,在0~2 m深度的土壤中,无机碳库储量超过2300 Pg,与土壤有机碳库储量相当(2400 Pg)(Batjes,1996;Zamanian et al., 2021)。这使得土壤无机碳在全球碳循环中的地位变得十分重要,因为如此大的碳库的微小变化可能会对全球碳循环和气候产生巨大的反馈作用(Lal et al., 1999)。尤其是在干旱半干旱地区,土壤无机碳库((1237±15) Pg,顶部2 m深度)储量超越了土壤有机碳库((646±9) Pg,顶部2 m深度)储量,成为陆地最主要的碳储库,半干旱区0~2 m土壤SIC含量可能比SOC含量高10倍,甚至高达17倍(Dı́az−Hernández et al., 2003;Emmerich,2003;Shi et al., 2012),无机碳的积累率也是有机碳的1.4倍(Landi et al., 2003;Lal,2008)。而且,全球干旱区面积为66.7×106 km2,占地球陆地面积的45.36%(Lal,2019),使得干旱—半干旱区土壤无机碳碳库成为全球碳库举足轻重的组成部分(图2)。
![]() 图 2 全球土壤无机碳密度分布图及其与年平均降水量低值区的相关性(据Zamanian et al., 2016修改)Figure 2. Global soil inorganic carbon carbon density distribution map and its correlation with the low annual mean precipitation area (modified from Zamanian et al., 2016)
图 2 全球土壤无机碳密度分布图及其与年平均降水量低值区的相关性(据Zamanian et al., 2016修改)Figure 2. Global soil inorganic carbon carbon density distribution map and its correlation with the low annual mean precipitation area (modified from Zamanian et al., 2016)而这一重要碳库,在早年的研究中始终没有得到足够的重视,直至近十几年才逐渐成为研究热点。这是因为从全球尺度来说,无机碳(即碳酸盐矿物)本身溶解−再沉淀过程中的全球循环,通常认为时间尺度是百万年的(Berner and Raiswell, 1983;Archer,2011;Martin,2017)。而干旱区土壤无机碳作为该循环的一环,曾被认为其积累速率通常在数千年的时间尺度(Monger and Gallegos,2000),一些成土碳酸盐的平均14C年龄在几千年上下(Pustovoytov,2003),在干旱区土壤中的平均停留时间较长,能达到85000年(Schlesinger,1985)。因此在20世纪80—90年代至21世纪初,多数学者始终认为土壤无机碳在自然界中的存在形式相对稳定,土壤无机碳库基本是一个“死库”,对现代碳循环的影响和贡献几乎可以忽略不计(Schlesinger,1985)。
然而,21世纪头十年间的许多研究报道显示,在全球范围内,使用涡度相关技术以及箱式法在对干旱荒漠区土壤CO2通量的监测过程中,发现了一个显著的夜间负通量(即土壤吸收大气CO2),报道地区包括了墨西哥巴哈(Baja)灌丛沙漠(39~52 gC m−2 a−1)、美国莫哈韦(Mojave)沙漠(102~127 gC m−2 a−1)、中国古尔班通古特沙漠(62~622 gC m−2 a−1)等(Hastings et al., 2005;Wohlfahrt et al., 2008;Xie et al., 2009)。伴随着2008年《Science》“本周新闻”栏目针对荒漠负通量问题发表评述(Stone,2008),提出这是否会作为一个碳循环中长期被忽略的碳汇,成为解决碳失汇新的突破口,干旱荒漠区土壤无机碳顿时成为研究热点,引发了巨大的关注。此后相关案例不断被报道,这些案例研究分布于北美洲的大盆地沙漠(Great Basin Desert)和赤华胡安沙漠(Chihuahuan Desert),亚洲的塔克拉玛干沙漠和毛乌素沙漠,南极洲的莫克莫多干谷(McMurdo Dry Valleys)等(Ball et al., 2009;Yates et al., 2013;Hamerlynck et al., 2013;Li et al., 2015;Fa et al., 2015;Liu et al., 2015a, b)。这些研究成果无一不推翻了土壤无机碳“死库”的固有认知,它的重要碳汇作用也在至今十余年的研究中逐步明确。
时至今日,干旱荒漠区土壤无机碳已成为国际研究热点,然而土壤无机碳库仍缺乏系统的综述。本文系统查阅了国际土壤无机碳相关研究进展,重点对土壤无机碳碳汇确认、碳库组成、来源识别,以及土壤无机碳碳汇影响因素进行了归纳总结,以期为干旱区土壤无机碳在全球碳循环中的碳汇作用与碳减排贡献研究提供参考。
土壤无机碳(SIC)主要指土壤中各种负价态的含碳无机化合物(黄巧云等,2015),广义的土壤无机碳包括了固、液、气三相,固相主要为钙镁碳酸盐,液相为土壤溶液中的碳酸根离子(H2CO3、HCO3−、CO32−),气相为土壤气体中的CO2,可能来自土壤呼吸或大气混入。本文主要通过对干旱区土壤无机碳的综述,探讨其碳汇作用,因此,在本文中所提及的土壤无机碳主要指狭义的固相与液相无机碳,以相对稳定的形态赋存于土壤中,暂不涉及气相无机碳,且液相无机碳在本文中单独以可溶性无机碳(Dissolved Inorganic Carbon,DIC)的概念提及。
2. 土壤无机碳汇确认
从21世纪初开始,伴随着干旱荒漠区土壤CO2负通量在全球各地的研究报导引发关注(Parsons et al., 2004;Hastings et al., 2005;Wohlfahrt et al., 2008;Xie et al., 2009),该负通量与土壤无机碳汇之间的联系在研究中被逐步明确,确认了荒漠地区CO2负通量来源于土壤无机固碳过程。
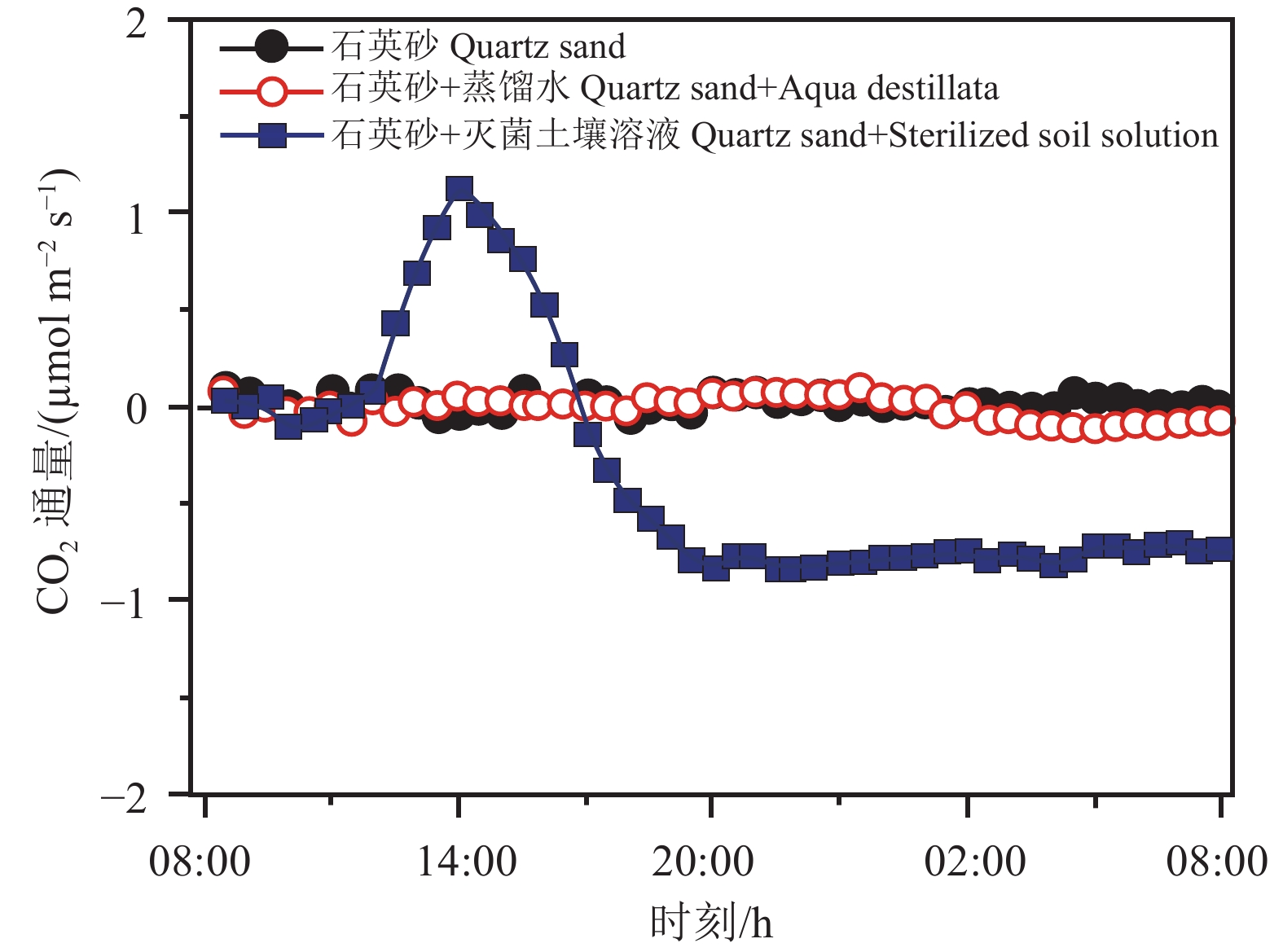
在2005—2008年间,多地科学家报道了干旱荒漠地区CO2负通量之后,学者们倾向于该负通量是由土壤中的有机过程引起。如墨西哥荒漠地区的研究认为负通量与灌木生长吸收CO2有关(Hastings et al., 2005);美国荒漠的研究则推测为荒漠地表生物结皮的碳累积(Wohlfahrt et al., 2008)。但此类有机碳的累积在宏观景观上必然产生可观测的变化,而这两类推测都没有得到可靠的实证(Schlesinger,2009)。此后的数项研究一起将结果导向了无机过程,Ma et al.(2013)在塔克拉玛干沙漠,通过对照实验,使用了石英砂、石英砂+蒸馏水、石英砂+灭菌土壤溶液(pH=8.97, EC=6 dS m−1)三组材料作为土壤基质,进行昼夜CO2通量测量;第一二组通量基本为零,验证了仪器测量的可靠性,第三组表现出了明显的昼夜负通量变化,排除了生物因素的影响,指向无机过程,推测该负通量为盐碱土中存在与温度相关的溶解度昼夜变化导致的“无机呼吸”过程(图3);Liu et al.(2015a,b)在宁夏毛乌素沙漠排除了生物因素影响之后,通过高频率测量和δ13C 同位素示踪技术互相印证,验证了负通量的真实存在,并且证实了该过程与土壤温度高度相关;通过动力学以及碳同位素示踪等方法,国外许多学者也验证了土壤温度、水分的变化会导致CO2溶解度以及土壤亚表层CO2分压的变化,促使干旱区土壤吸收与排放CO2(Parsons et al., 2004;Takle et al., 2004;Shanhun et al., 2012;Hamerlynck et al., 2013;Soper et al., 2017)。
![]() 图 3 荒漠土壤CO2负通量的对比实验验证(据Ma et al., 2013修改)Figure 3. Comparative experimental validation of negative CO2 fluxes in desert soils (modified from Ma et al., 2013)
图 3 荒漠土壤CO2负通量的对比实验验证(据Ma et al., 2013修改)Figure 3. Comparative experimental validation of negative CO2 fluxes in desert soils (modified from Ma et al., 2013)一些研究也估算得到了相对可靠的数据量级,在此前报道的基础上进行了多手段验证(表1)。如塔克拉玛干沙漠的研究采用14C 示踪技术对土壤吸收 CO2 过程进行验证,并根据14C 衰变期,推算出0~1000年土壤碳吸收速率约为 21.4 g C m−2 a−1(Li et al., 2015);毛乌素沙地的研究通过δ13C同位素示踪技术与土壤 CO2 通量观测的相互印证,两种途径所得出的土壤碳年吸收量基本吻合,CO2吸收速率约为 28 g C m−2 a−1(Liu et al., 2015a)。
表 1 全球干旱荒漠区CO2负通量报告统计(据Schlesinger,2017修改)Table 1. Global negative CO2 flux reporting statistics for arid desert regions (modified from Schlesinger, 2017)研究地点 年平均
降水量/
mm负通量/
(g C m−2 a−1)文献来源 墨西哥,下加利福尼亚州 174 39~52 Hastings et al., 2005 美国,莫哈韦沙漠 150 102~127 Jasoni et al., 2005;Wohlfahrt et al., 2008 中国,古尔班通古特沙漠 160 62~622 Xie et al., 2009 173 49 Liu et al., 2012 164 25 Ma et al., 2014 中国,宁夏 287 77 Jia et al., 2014 275 28 Liu et al., 2015a 中国,塔里木盆地 21 Li et al., 2015 至此,干旱荒漠区负通量所对应的主要土壤固碳的过程被确定为简单的碳酸盐无机反应(以碳酸钙为代表):
CO2+H2O↔H++HCO−3 (1) Ca2++2HCO−3↔CaCO3+H2O+CO2 (2) 干旱荒漠区土壤无机碳汇得到初步确认,土壤无机碳库不再是一个“死库”,它的动态活跃已毋庸置疑。但就如Schlesinger在评述文章中指出,对于干旱区土壤无机碳汇作用的确认,还需辨析土壤无机碳来源以及确认碳汇去向(即碳汇储库)(Schlesinger et al.,2009;Schlesinger,2017),伴随争议这成为了新的研究焦点。
3. 土壤无机碳碳库组成
当土壤固碳的过程被确定为简单的碳酸盐无机反应,土壤无机碳库空间位置及碳库组成就成为新的研究热点。
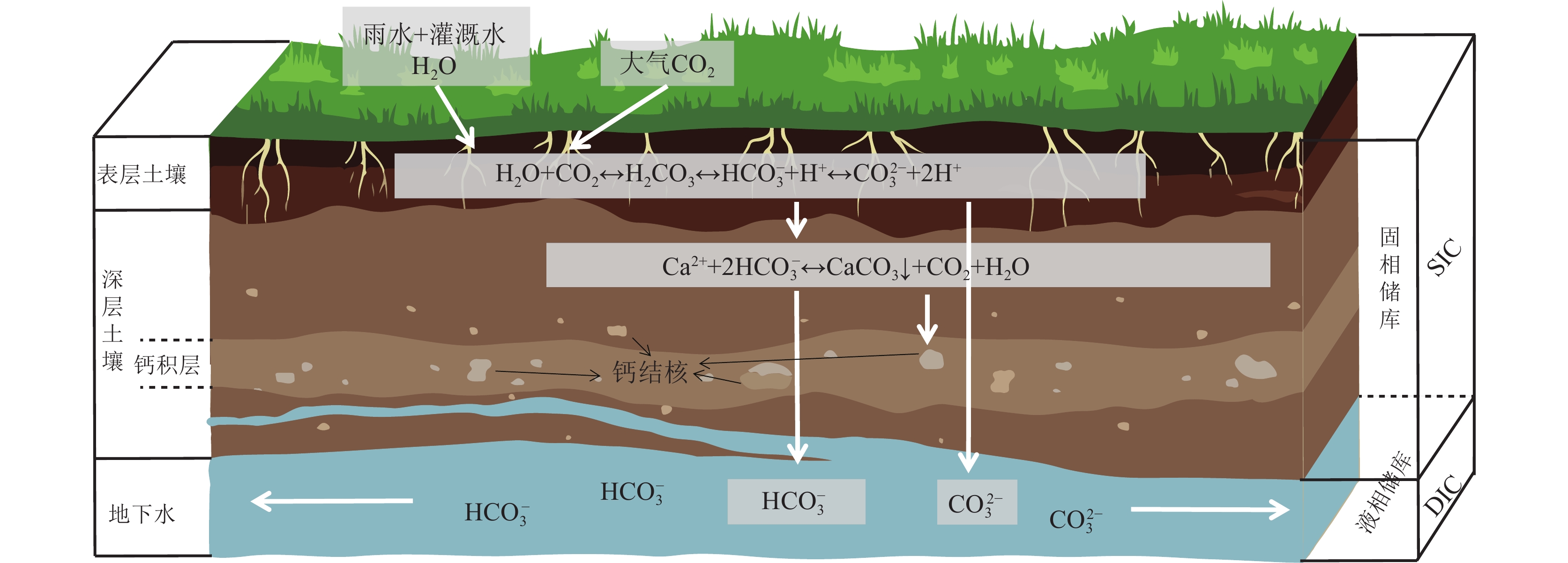
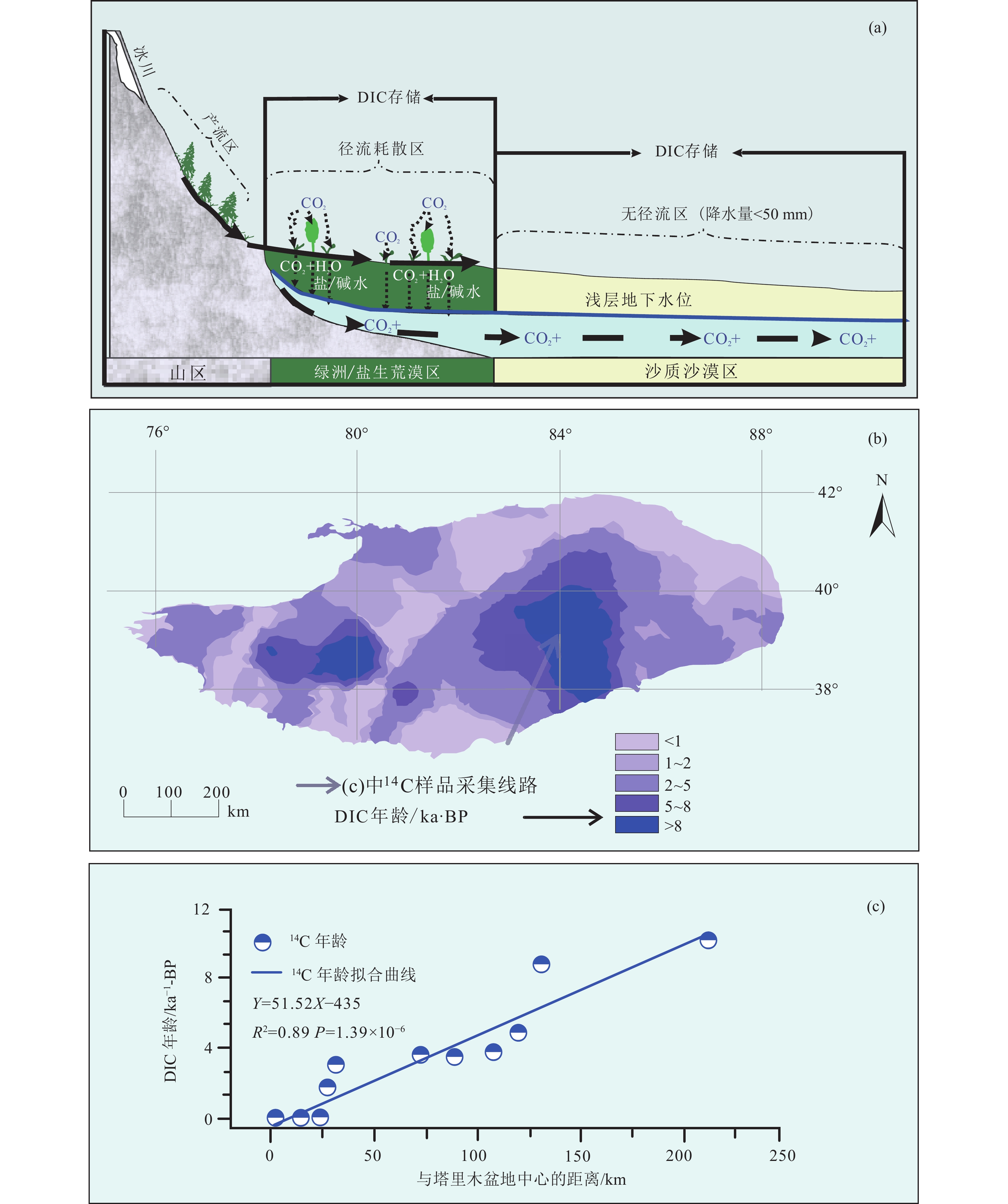
干旱区土壤在固定大气CO2形成次生碳酸盐的过程中以土壤溶液为媒介,次生碳酸盐首先以可溶性无机碳DIC的形式赋存在土壤液相中。伴随着土壤溶液的蒸发,DIC可能与溶液中钙离子结合转化为固相碳酸盐矿物而固存下来,抑或伴随土壤溶液的下渗,DIC被携带进入地下水系始终以液相固存于相对封闭的咸水盆地中(Liu et al., 2015a;Li et al., 2015;图4)。
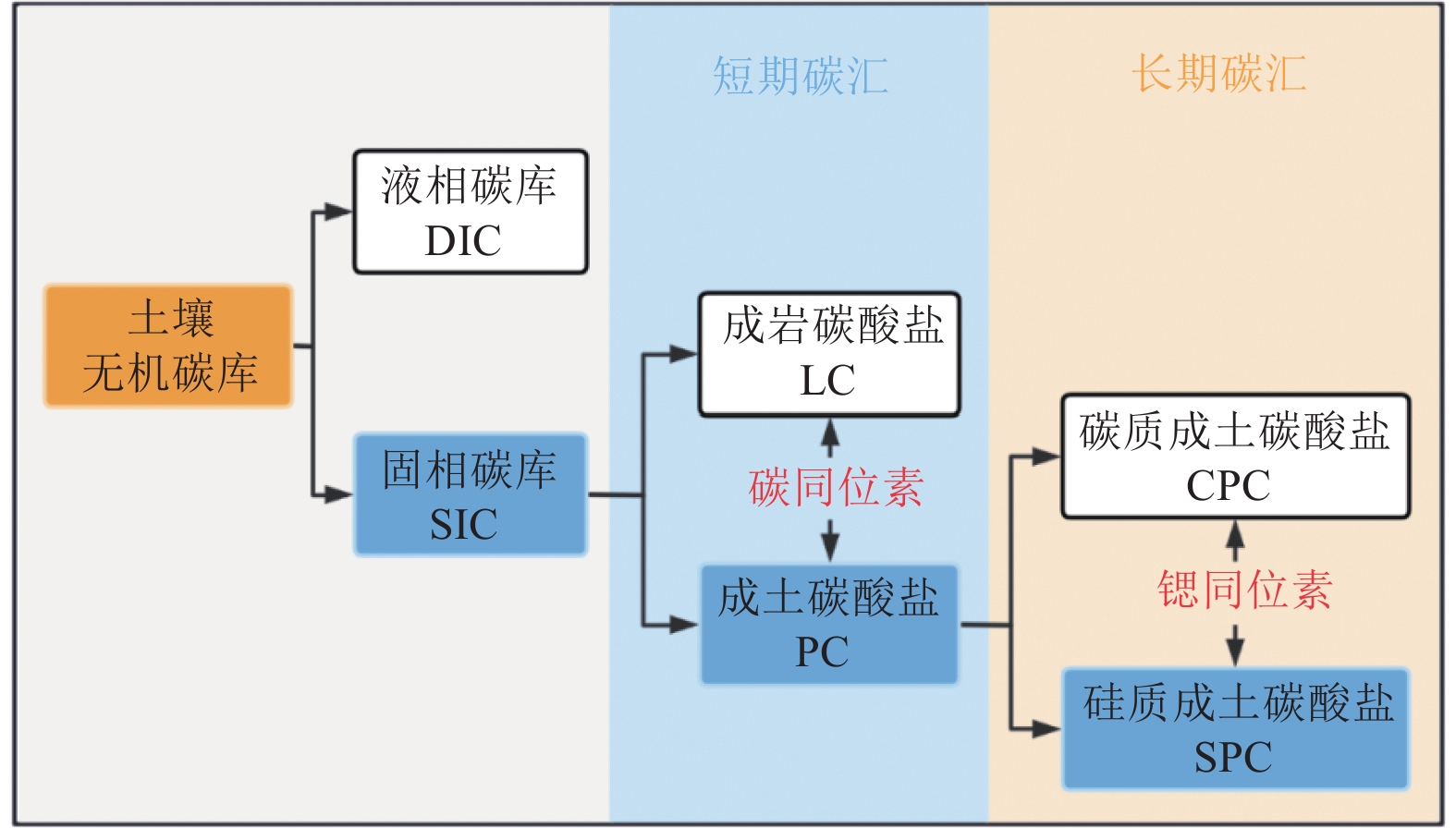
因此,土壤无机碳库从赋存的介质上进行分类,可分为固相储库与液相储库。固相储库依据无机碳来源的不同又可分为成土碳酸盐(PC)与成岩碳酸盐(LC),成土碳酸盐又可分为钙质成土碳酸盐(CPC)与硅质成土碳酸盐(SPC)。它们共同组成了土壤无机碳库,具备着不同的碳汇功能,可利用碳同位素与锶同位素进行定量识别(图5)。
3.1 液相碳库
土壤无机碳液相储库是指赋存在土壤溶液以及地下水中,以可溶性无机碳形式存在的无机碳库。它们是土壤碳酸盐发生溶解,或当昼夜温度变化导致土壤CO2负通量产生,溶解于土壤溶液中的CO2(DIC)随水被向下淋洗进入地下水,形成的液相无机碳汇(Ma et al., 2014;李彦等,2016)。这一储库不同于固相储库,土壤无机碳的产生与储存在空间上、载体上均有错位(李彦等,2016),对此的认知是逐步清晰的。
Ma et al.(2013)在塔里木盆地的研究中首先发现,在主导CO2负通量的无机过程中,土壤溶液中可溶性无机碳的淋滤可能会影响净碳,为他们发现盐碱土“无机呼吸”带来的重要启示:当温度变化导致的溶解度变化制造出了一个显著的昼夜CO2通量变化,那么溶解于土壤溶液中的CO2(DIC)数量必定可观,当这些DIC被向下淋洗进入地下水,将导致形成碳汇(Ma et al., 2014;李彦等,2016)。
Li et al.(2015)在之后的研究中利用14C技术,就地下水可溶性无机碳是否能成为干旱荒漠区无机碳储库给出了论证。年轻的DIC年龄表明了其现代大气来源以及伴随土壤溶液由地表被携带至地下的垂向运动,从塔里木盆地南缘到中心地下潜水中DIC的年龄线性增加,表明了DIC伴随地下水由边缘绿洲相沙漠中心区的缓慢水平运动,最终汇集在地下咸水盆地形成碳汇(Li et al., 2015;图6)。
![]() 图 6 塔里木盆地土壤无机碳液相储库DIC淋溶传输(据Li et al., 2015)a—DIC淋溶传输示意图;b—DIC14C测年年龄等值线图;c—塔里木盆地边缘至中心的地下水DIC年龄Figure 6. DIC leaching transport of soil inorganic carbon liquid phase reservoirs in the Tarim Basin (after Li et al., 2015)a−Schematic diagram of DIC leaching transport; b−DIC14C dating age contour map; c−DIC age of groundwater from the edge to the center of the Tarim Basin
图 6 塔里木盆地土壤无机碳液相储库DIC淋溶传输(据Li et al., 2015)a—DIC淋溶传输示意图;b—DIC14C测年年龄等值线图;c—塔里木盆地边缘至中心的地下水DIC年龄Figure 6. DIC leaching transport of soil inorganic carbon liquid phase reservoirs in the Tarim Basin (after Li et al., 2015)a−Schematic diagram of DIC leaching transport; b−DIC14C dating age contour map; c−DIC age of groundwater from the edge to the center of the Tarim Basin与利用地下盐水含水层的CCS技术(碳捕获及封存技术)的溶解捕获原理类似,就像被注入不透水盖层之下盐水含水层(深度>1 km)的CO2被封存,并静待矿化一样(王建秀等,2013;Soltanian and Dai,2017),当DIC进入一个被厚厚的沙土盖层覆盖的地下咸水层,CO2分压可能比地表高出一个数量级,DIC溶解度甚至超过海水的两倍,同时DIC伴随水平迁移,汇集在咸水盆地的低洼处(Li et al., 2015)。这有如一项在自然条件下地球自发进行的碳捕获与封存过程,更进一步推断,在这片沙漠地下的“海洋”中,在漫长的地质时间里,过饱和的DIC会与岩石和咸水反应、矿化,从而最终形成地球化学捕获。这一自土壤无机碳转移汇集而来的液相碳库成为了连接短期表生碳循环与长期地质碳循环的重要渠道。以该研究所估计的地下水可溶性无机碳储量推算,全球可溶性无机碳库的储量高达1000 Pg,每年的DIC汇也达到了0.2 Pg C a−1,足以被认为是陆地第三大活跃碳库(Li et al., 2015)。
但以液相固存土壤无机碳的前提条件是,短时间内有较充足的水分输入,驱动和携带大量新生可溶性无机碳(DIC)快速运移至地下水体,干旱荒漠区本身伴随排盐过程的自然雪水补给可能不足以支撑大规模的DIC迁移(法科宇等,2018)。对此Li et al.(2015)将视线聚焦在了塔里木盆地边缘的绿洲灌溉区,无疑人为灌溉加强了下渗作用,补充的大量灌溉水会促使DIC碳汇的显著增加,而内流河盆地使得无机碳以液相稳定储存于荒漠地下咸水层(图6)。但这也导致了农业灌溉区的存在以及封闭的内流河盆地地下水系统成为了必要而特殊的条件,使得此类储库的适用范围受到了一定的限制。
在普遍缺乏水分补给的各类干旱区,CO2溶于水形成可溶性无机碳后,液相中新形成的可溶性无机碳短时间内可能不会或大部分不会进入地下水体中,也难以大量保持液相态存留土壤中,则其可能在运移至地下水体之前大量发生转化,主要转化为固相碳酸盐矿物留存在土壤剖面中(Yates et al.,2013;Liu et al., 2015a)。
与此同时,科学家也计算了美国西南部荒漠、毛乌素沙漠的地下水补给量与DIC最大携带浓度,得出的DIC输入速率分别为1.78 g C m−2 a−1 与2.5~4.2 g C m−2 a−1 ,均低于基于CO2负通量所计算出的固碳速率,这两者的不匹配表征着目前的解释可能仍存在问题(Schlesinger,2017;法科宇等,2018;Fa et al., 2021)。但这些仍然不可否认干旱区地下水可溶性无机碳汇是一个十分重要而又出乎意料的干旱区土壤无机碳汇。
3.2 固相碳库
土壤无机碳固相储库是指赋存于土壤中,以固态碳酸盐(SIC)的形式存在的无机碳库。大气CO2溶解形成的可溶性无机碳,在土壤温度升高、水分蒸发等条件下产生溶解度变化,导致其与土壤溶液中的钙镁离子结合,析出碳酸镁、碳酸钙等固相碳酸盐矿物,在干旱地区,新形成的碳酸盐并不会在短时间内溶解流失,与风化搬运而来的原生碳酸盐颗粒混合,共同在土壤剖面中形成较为稳定的固相储库。
Liu et al.(2015a)在毛乌素沙地应用了δ13C同位素标记技术,发现大气CO2进入土壤并溶解在土壤水中,当温度升高时,大部分溶解的CO2返回大气,而剩余的溶解CO2与土壤中的一些物质反应,在48小时内释放了7.1%,72.8%储存在土壤固相中,0.0007%储存在气相中,20.0%可能储存在液相中。即大多数溶解的CO2以碳酸盐的形式被固定,而剖面上也可观察到次生碳酸盐的富集,表现为钙结核、钙积层等形态(Liu et al., 2015a)。该项研究所确定的碳酸盐固碳速率与直接高频率测量土壤CO2负通量的速率基本吻合,印证了该储库的可靠性。Gao et al.(2020)在黄土高原地区应用类似方法也观察到33.2%被吸收的CO2固定在土壤固相中。与此同时,中外许多学者对于土壤碳酸盐中成土碳酸盐的区分研究也证实了土壤剖面中大量存在次生碳酸盐,侧面印证了这一固相储库普遍存在(Magaritz and Amiel,1980;潘根兴,1999;Morgun et al., 2008;郑聚锋等,2011;张林等,2010;Bayat et al., 2021)。
但固相碳库具备不同组成部分,并非所有固相无机碳均具备碳汇功能(图5)。事实上,关于土壤无机碳,尤其是干旱、半干旱区土壤无机碳源汇问题的讨论已经持续了20余年(Grossman et al., 1995;Schlesinger,1999,2017;Ma et al., 2014)。土壤无机碳是一个有效的碳汇(Yates et al.,2013;Monger,2014;Gao et al., 2020),还是长期稳定的碳储库(Schlesinger,1985),抑或甚至反而成为一个碳源(Zamanian et al., 2021)?这个问题的解决始终离不开对与土壤无机碳碳库有关的土壤碳酸盐成因来源辨析,这已成为了当前研究的焦点与难点。
3.2.1 成土碳酸盐与成岩碳酸盐
根据碳酸根离子来源,首先可将土壤固相碳酸盐分为2种,分别是成岩碳酸盐(或原生碳酸盐)和成土碳酸盐(或次生碳酸盐)。
(1)成岩碳酸盐(LC)
成岩碳酸盐(Lithogenic Carbonate,LC)是指在地质历史时期水生环境中形成的碳酸盐岩(主要是灰岩、白云岩)中产生的碎屑颗粒,又称原生碳酸盐,土壤中的成岩碳酸盐主要来源于成土母质或母岩,是未经风化成土作用而自然保存下来的碳酸盐(Monger et al.,2015)。成岩碳酸盐为物理风化与机械搬运而来,并不涉及固碳作用,但其可作为成土碳酸盐形成的离子来源之一参与固碳过程。
(2)成土碳酸盐(PC)
成土碳酸盐(Pedogenic Carbonate,PC)则指在土壤风化成土过程中自生形成的碳酸盐,又称次生碳酸盐,是通过大气CO2溶解于土壤溶液,形成碳酸根或重碳酸根离子,然后与各种矿物(如LC、硅酸盐矿物、降尘和化肥等)的Ca2+、Mg2+在适宜的水分、pH等条件下沉淀形成的(Schlesinger,1982;Batjes,1996;Wang et al., 2018)。
PC所固定的溶解CO2直接或间接地来自大气(土壤CO2=大气CO2+呼吸作用CO2=大气源CO2),在较短的时间尺度上(ka),可以近似地认为次生碳酸盐的形成是主要的固碳过程(Monger and Gallegos,2000),涉及反应式(1)和(2)。
成土碳酸盐的形成与累积在干旱、半干旱土壤中是十分常见的。一般来说,湿润和半湿润地区的土壤是酸性的,这促使反应(1)向左移动,导致二氧化碳释放到大气中,因此土壤剖面中积累的次生碳酸盐很少。然而,干旱和半干旱地区的土壤具有较高的pH值(通常大于8),而且地下水和河水中含有大量的Ca2+、Mg2+,蒸发量远大于降水量的气候条件下,大大促进了土壤剖面中CaCO3的沉淀(Wang et al., 2018)。
(3)识别方法
在景观、剖面和微观形态三种尺度上,次生成因的成土碳酸岩都有其形态特点,有助于对成土碳酸盐的肉眼和镜下分辨(Gile et al., 1966;Birkeland,1999;Brock and Buck,2005;Monger et al.,2015;Zamanian et al.,2016)。
在景观尺度上,成岩碳酸盐主要以灰岩地层的形式呈现,其形态取决于原生地层的形态(图7a);而次生碳酸盐体则以地下层位的形式出现,基本与地表平行,深度为1~2 m,越古老的地貌表面通常含有越多的成土碳酸盐(Birkeland,1999;Monger et al.,2015;图7)。
![]() 图 7 景观与剖面尺度中原生碳酸盐与次生碳酸盐赋存形态区别a—成岩碳酸盐景观与剖面照片,包含灰岩地层原位风化的LC以及冲积搬运的LC碎屑(Monger et al.,2015);b、e—剖面上的PC钙质菌丝体与胶膜(Zamanian et al.,2016;达佳伟,2020);c、f—剖面上的PC钙结核(Zamanian et al.,2016;达佳伟,2020);d—剖面中的PC层状钙板(达佳伟,2020);g—黄土中的PC钙质根石(Zamanian et al.,2016)Figure 7. Difference between primary and secondary carbonate fugacity patterns in landscape and profile scalea−Photos of mafic carbonate landscapes and profiles containing in situ weathered LC from tuff strata and alluvially transported LC debris (Monger et al., 2015); b, e−PC calcareous mycelium with colloidal film in profiles (Zamanian et al., 2016; Da Jiawei, 2020); c, f−PC calcium nodules in profiles (Zamanian et al., 2016; Da Jiawei, 2020); d−PC laminated calcium plates in the profile (Da Jiawei, 2020); g−PC calcareous rhizoliths in the loess (Zamanian et al., 2016)
图 7 景观与剖面尺度中原生碳酸盐与次生碳酸盐赋存形态区别a—成岩碳酸盐景观与剖面照片,包含灰岩地层原位风化的LC以及冲积搬运的LC碎屑(Monger et al.,2015);b、e—剖面上的PC钙质菌丝体与胶膜(Zamanian et al.,2016;达佳伟,2020);c、f—剖面上的PC钙结核(Zamanian et al.,2016;达佳伟,2020);d—剖面中的PC层状钙板(达佳伟,2020);g—黄土中的PC钙质根石(Zamanian et al.,2016)Figure 7. Difference between primary and secondary carbonate fugacity patterns in landscape and profile scalea−Photos of mafic carbonate landscapes and profiles containing in situ weathered LC from tuff strata and alluvially transported LC debris (Monger et al., 2015); b, e−PC calcareous mycelium with colloidal film in profiles (Zamanian et al., 2016; Da Jiawei, 2020); c, f−PC calcium nodules in profiles (Zamanian et al., 2016; Da Jiawei, 2020); d−PC laminated calcium plates in the profile (Da Jiawei, 2020); g−PC calcareous rhizoliths in the loess (Zamanian et al., 2016)在剖面尺度上,可观察到的成岩碳酸盐主要为经过风化搬运后散布在土层中肉眼可见的碎块与碎屑,视其与物源的远近不同具备不同程度的磨圆与侵蚀痕迹;成土碳酸盐则是在成土过程中逐渐形成,细小而松散地分布在土壤基质中,并逐步聚集成层,不同阶段表现为钙质菌丝体与胶膜、钙结核、钙积层、层状钙板等不同的对应形态(Gile et al., 1966;达佳伟,2020;图7b~f),此外也包括了碎屑底部的碳酸盐悬垂物(Carbon pendant)、节理填充物以及与围绕植物根系形成的钙质根石(Rhizoliths)等形态(Brock and Buck,2005;Zamanian et al., 2016;图7g)。
在微观形态尺度上,成岩碳酸盐碎屑颗粒通常磨圆度较高,可观察到溶蚀边缘,较难分辨,假如存在海洋化石更有助于区分(Monger et al., 2015;图8 b);成土碳酸盐则以自形晶体和钙化生物体的形式出现,通常晶体粒度较细,形态各异,对应不同成因(图8),包括非生物成因:沉淀于土壤孔隙以及通道璧上的膜层、围绕硅酸岩矿物颗粒生长的膜层、假菌丝体、钙结核等;生物相关成因:钙化根(由植物根系根皮层钙化而来)、蚯蚓球晶(由蚯蚓的钙化腺体产生)等(Monger et al.,2015;Zamanian et al.,2016;达佳伟,2020)。
![]() 图 8 微观尺度中原生碳酸盐与次生碳酸盐赋存形态区别a—钙结核土壤基质中混入的LC颗粒(刘恋等,2010);b—含海洋化石的LC颗粒(Monger et al.,2015);c—钙结核内部PC,包括分布于土壤孔隙中的亮晶方解石以及土壤基质中的泥晶方解石(达佳伟,2020);d—土壤孔隙璧上的PC钙膜(Zamanian et al.,2016);e—钙结核中围绕原生石英及长石颗粒生长的PC(达佳伟,2020);f—假菌丝体中的针状方解石(Monger et al.,2015);g—镜下PC结核以及碎屑表面PC钙膜(Zamanian et al.,2005);h—钙化根,可见细胞结构(Zamanian et al.,2016);i—蚯蚓球晶,正交偏光下(Zamanian et al.,2016)Figure 8. Difference between primary and secondary carbonate fugitive morphology in microscalea−LC particles mixed in the soil matrix of calcium nodules (Liu Lian et al., 2010); b−LC particles containing marine fossils (Monger et al., 2015); c−PC inside calcium nodules, including leucocrystalline calcite distributed in soil pores and mud−crystalline calcite in the soil matrix (Da Jiawei, 2020); d−PC calcium film on soil pore jams (Zamanian et al., 2016); e−PC growing around primary quartz and feldspar grains in calcium nodules (Da Jiawei, 2020); f−Nneedle−like calcite in pseudomycorrhiza (Monger et al., 2015); g−Microscopic PC nodules as well as PC calcium films on the surface of debris (Zamanian et al., 2005); h−Calcified roots with visible cellular structures (Zamanian et al., 2016); i− Earthworm spherical crystals, under orthogonal polarization (Zamanian et al., 2016)
图 8 微观尺度中原生碳酸盐与次生碳酸盐赋存形态区别a—钙结核土壤基质中混入的LC颗粒(刘恋等,2010);b—含海洋化石的LC颗粒(Monger et al.,2015);c—钙结核内部PC,包括分布于土壤孔隙中的亮晶方解石以及土壤基质中的泥晶方解石(达佳伟,2020);d—土壤孔隙璧上的PC钙膜(Zamanian et al.,2016);e—钙结核中围绕原生石英及长石颗粒生长的PC(达佳伟,2020);f—假菌丝体中的针状方解石(Monger et al.,2015);g—镜下PC结核以及碎屑表面PC钙膜(Zamanian et al.,2005);h—钙化根,可见细胞结构(Zamanian et al.,2016);i—蚯蚓球晶,正交偏光下(Zamanian et al.,2016)Figure 8. Difference between primary and secondary carbonate fugitive morphology in microscalea−LC particles mixed in the soil matrix of calcium nodules (Liu Lian et al., 2010); b−LC particles containing marine fossils (Monger et al., 2015); c−PC inside calcium nodules, including leucocrystalline calcite distributed in soil pores and mud−crystalline calcite in the soil matrix (Da Jiawei, 2020); d−PC calcium film on soil pore jams (Zamanian et al., 2016); e−PC growing around primary quartz and feldspar grains in calcium nodules (Da Jiawei, 2020); f−Nneedle−like calcite in pseudomycorrhiza (Monger et al., 2015); g−Microscopic PC nodules as well as PC calcium films on the surface of debris (Zamanian et al., 2005); h−Calcified roots with visible cellular structures (Zamanian et al., 2016); i− Earthworm spherical crystals, under orthogonal polarization (Zamanian et al., 2016)有些研究者,通过机械分离碳酸盐悬垂物(Carbon pendant)、结核、胶膜等得到较纯的成土碳酸盐(Landi et al., 2003;Burgener et al.,2016;Zamanian et al.,2016),但物理分离的方法应用在具体的研究场景中有其局限性,且难以确认PC与LC的整体比例。为了解决这一问题,碳同位素被成功地应用于识别成岩碳酸盐和成土碳酸盐(Magaritz and Amiel,1980;Nordt et al., 1998;Ryskov et al., 2008)。
成土碳酸盐的同位素组成受其形成的土壤CO2的δ13C值和碳酸盐从土壤溶液中析出过程中的同位素分馏控制(Ryskov et al.,2008)。在土壤溶液中,溶解的碳酸氢盐与土壤CO2的同位素交换在成土碳酸盐形成之前就已经完成(Quade et al.,1989)。因此,成土碳酸盐岩的碳同位素组成并非继承自岩石成因组分,而取决于土壤CO2的碳同位素值。这一数值受控于植被根系与土壤微生物的呼吸作用与有机质的分解,以及大气CO2的混入比例(Da et al., 2019,2020)。有研究显示,土壤CO2的碳同位素值比其来源的土壤有机碳重约4.4‰ (Cerling,1984;Quade et al., 1989),该值也可通过对土壤CO2的δ13C实测得到(张林等,2010;李杨梅等,2018)。在开放的土壤体系中,成土碳酸盐从土壤溶液中沉积时,存在与温度相关的碳同位素分馏,依据分馏值和土壤CO2的δ13C值可得到成土碳酸盐的δ13C值(Ryskov et al.,2008),由于条件和过程的多样性,成土碳酸盐岩的δ13C值可介于−10‰~0‰(Salomons et al., 1978)。而原生碳酸盐岩的δ13C值在0‰左右,−2 ‰~+ 2‰(Hoefs, 1997;Cerling,1984;Quade et al., 1989;Marion et al., 1991)。利用两者的差异,可以使用式(3)确定土壤中PC的比例(Ryskov et al.,2008):
PC(%)=[δ13CSIC-δ13CLC]/[δ13CPC-δ13CLC]×100 (3) 在众多研究中,已成功利用这一方法明确了土壤无机碳中的成土碳酸盐占比与含量(表2)。但值得注意的是,由于土壤CO2δ13C值并不稳定,随时间会产生一定波动,在空间上也并非十分均一,故而较难准确定量区分成岩碳酸盐和成土碳酸盐,需要在研究中考虑到这一局限性。
表 2 基于δ13C值估算的不同地区土壤无机碳PC与LC占比Table 2. Estimated percentage of soil inorganic carbon PC and LC in different regions based on δ13C values地点 PC占比/
%PC含量/(g/kg) 文献来源 塔里木盆地阿拉尔垦区 1.33~35.7 1.34~56.36 李杨梅等,2018 内蒙古乌兰察布 17.4~83.6 42~177 张林等,2010 俄罗斯 20~50 / Morgun et al., 2008 俄罗斯 66.8~73.8 26.9~60.1 Ryskov et al., 2008 美国德克萨斯州 2~11,
9~20,
60~70,
17~100/ Nordt et al., 1998 美国德克萨斯州 40~90 / Rabenhorst et al., 1983 以色列 30~60 / Magaritz and Amiel, 1980 此外,一些研究发现不同的矿物类型也有助于定量区分成岩碳酸盐和成土碳酸盐,例如Meng et al.(2015,2018)提出了土壤白云石可用于判别原生和次生碳酸盐比例的方法,在土壤中,白云石几乎都是来自于成土母质,其不能溶解后再形成,即白云石的存在代表成岩碳酸盐的存在,而方解石的溶解速率远快于白云石,即白云石被完全溶解时,存在的方解石为再沉淀形成的纯成壤来源。然而该方法也受成岩碳酸盐种类及含量的影响。
3.2.2 钙质成土碳酸盐与硅质成土碳酸盐
从土壤无机碳(SIC)中区分得到成土碳酸盐与成岩碳酸盐后,土壤成土碳酸盐是否能代表土壤无机碳真正的固碳能力呢?答案是有争议的,关键是分辨其阳离子(钙镁离子)来源(Liu et al., 2010;Schlesinger,2017)。成土碳酸盐形成的阳离子来源包含原生碳酸盐溶解以及硅酸盐风化两部分,据此可将成土碳酸盐进一步区分为钙质成土碳酸盐(CPC,Calcitic pedogenic carbonate)与硅质成土碳酸盐(SPC,Silicatic pedogenic carbonate),两者涉及不同的风化反应(Monger et al.,2015;图9)。
![]() 图 9 不同来源成土碳酸盐风化与固碳过程示意图(据Monger et al.,2015修改)Figure 9. Schematic diagram of carbonate weathering and carbon sequestration processes in different sources of soil−forming carbonates (modified from Monger et al., 2015)
图 9 不同来源成土碳酸盐风化与固碳过程示意图(据Monger et al.,2015修改)Figure 9. Schematic diagram of carbonate weathering and carbon sequestration processes in different sources of soil−forming carbonates (modified from Monger et al., 2015)(1)钙质成土碳酸盐(CPC)
碳酸盐风化钙源来自碳酸盐溶解再沉淀反应(CD-RPpt反应,Carbonate Dissolution-Reprecipitation Reaction),为可逆平衡反应:
CaCO3+CO2+H2O⇋ (4) 此类经过CD−RPpt反应从先前存在的碳酸盐中获得钙所形成的成土碳酸盐称为钙质成土碳酸盐(CPC)。先前存在的碳酸盐最常见的是灰岩颗粒,也可以是白云岩、泥灰岩、钙质砂岩,甚至现有的成土碳酸盐。
在成土作用过程中,伴随原生碳酸盐的溶解所吸收的大气CO2,在成土过程中伴随次生碳酸盐的沉淀等量返回到大气中,与大气CO2的净交换为零。具体可表示为:
CaCO3 (原生碳酸盐)+ H2O + CO2↓→
\left.\mathrm{Ca}^{2+}+2 \mathrm{HCO}_3^{-} \rightarrow \mathrm{CaCO}_3 \text { (次生碳酸盐) }\right.+\mathrm{H}_2 \mathrm{O}+\mathrm{CO}_2 \uparrow (5) 因此,在长期的地质表生交换过程中,CPC的形成过程并未形成净碳汇 (Liu,2011),并不具备固碳效应,因此,在国际上该类碳酸盐并未被认可计入干旱区土壤碳汇强度中(Schlesinger,1985;Berner,1992;Sombroek et al., 1993;Schlesinger,2017)。但值得注意的是,探讨的时空尺度不同,可能会带来不同的结论。全球尺度上,碳酸盐矿物的沉淀和溶解,在>106年的时间尺度上被认为是平衡的,提供了一个互相抵消的源和汇,而导致在这样的长期尺度上,碳酸盐碳库被认为对全球碳循环来说没有实质贡献(Berner and Raiswell, 1983;Archer,2011;Martin,2017)。但这一循环是相当复杂动态且漫长的过程,因此在较短的时间尺度上(102~105年),碳酸盐矿物的溶解或沉积对全球气候的贡献是不平衡的(Martin,2017),干旱区土壤无机碳的沉淀被认为具备碳汇意义,即使钙离子来源于原生碳酸盐矿物的风化,碳质成土碳酸盐的碳汇作用还是不容忽视。
(2)硅质成土碳酸盐(SPC)
硅酸盐风化钙源则来自Ebelmen−Urey反应,为单向反应(Berner,2004):
\mathrm{CO}_2+\mathrm{CaSiO}_3 \rightarrow \mathrm{CaCO}_3+\mathrm{SiO}_2 (6) Ca、Mg硅酸盐的风化是控制地球大气CO2长期浓度的主要因素,释放的Ca2+和Mg2+沉淀为海洋碳酸盐,从而消耗地幔脱气释放的CO2,两者的负反馈作用维持了地球长期的宜居性和碳循环平衡(Berner et al., 1983)。
通过Ebelmen−Urey反应从硅酸盐矿物中获得的钙所形成的成土碳酸盐称为硅质成土碳酸盐(SPC)。除了火成岩和变质岩外,钙还可以来自砂岩、页岩,甚至不纯石灰石中的硅酸盐。SPC形成的整个过程包括硅酸钙的风化与碳酸钙的沉淀:
\mathrm{CaSiO}_3+2 \mathrm{CO}_2 \downarrow+3 \mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{Ca}^{2+}+2 \mathrm{HCO}_3^{-}+\mathrm{H}_4 \mathrm{SiO}_4 (7) \mathrm{Ca}^{2+}+2 \mathrm{HCO}_3^{-} \rightarrow \mathrm{CaCO}_3(\mathrm{SPC})+\mathrm{CO}_2 \uparrow+\mathrm{H}_2 \mathrm{O} (8) 从上述计算可得,每1 mol SPC形成,伴随了1 mol 大气CO2的消耗,产生了净碳汇,被认为是真正具备碳汇作用的土壤无机碳固碳过程,而硅质成土碳酸盐的形成速率普遍被认为代表了成土碳酸盐的真实固碳速率(Schlesinger,2017)。
(3)碳酸盐世代
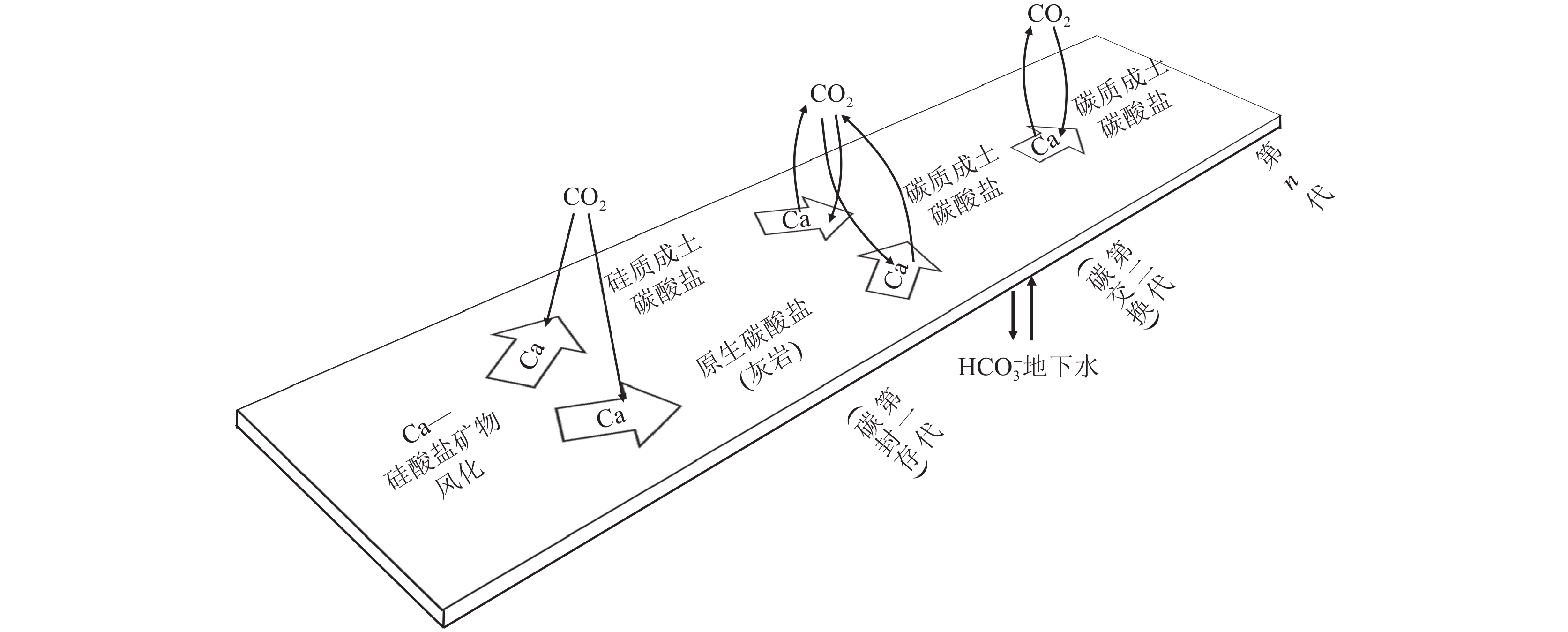
在对土壤无机碳的划分方案的讨论中,其根本目的是为了服务于具体的科学问题,为更好地探讨土壤无机碳在固碳方面的贡献,Monger et al. (2015)年提出“世代”概念—一个基于钙源的适用于无机碳固碳作用评估的分类系统。
Monger解释,“世代”的概念可以理解为,存在一个表面,它代表了上方有大气CO2,下方有地下水的土壤(图10)。硅酸钙通过Ebelmen−Urey反应消耗大气CO2,并在硅质土壤碳酸盐中封存碳,这些形式的碳酸盐被称为“第一代”。随后通过CD−RPt反应溶解的原生碳酸盐和硅质土壤碳酸盐进行碳交换(无净封存),形成的钙质成土碳酸盐被称为“第二代”。随后连续的溶解−再沉淀循环也通过CD−RPpt反应进行,被称为第n代,同样只有交换,没有封存。
![]() 图 10 碳酸盐世代分类示意图(据Monger et al.,2015修改)Figure 10. Schematic diagram of carbonate generation classification (modified from Monger et al., 2015)
图 10 碳酸盐世代分类示意图(据Monger et al.,2015修改)Figure 10. Schematic diagram of carbonate generation classification (modified from Monger et al., 2015)这样分类的结果是,为了通过土壤碳酸盐固碳,当钙从硅酸盐中释放出来时,只能使用一次,而如何区分第一代、第二代和第n代仍是一个挑战(Monger et al.,2015)。
(4)识别方法
由于硅质成土碳酸盐(SPC)被认为代表了真正的土壤无机碳汇部分,因此SPC与CPC的识别对于准确计算无机碳酸盐的碳汇作用意义重大。
目前,对于CPC与SPC的准确区分仍是十分困难的。由于钙同位素在表生过程中存在复杂的分馏过程,且δ44/40Ca、δ44/42Ca的测试技术尚不够成熟。因此,目前还难以实现应用钙同位素识别Ca2+来源。
Sr与Ca同属元素周期表中的第2族,Sr2+与Ca2+经常类质同象替换,进入含Ca矿物中,其在表生循环过程中的地球化学行为与钙相似。在自然界中存在84Sr、86Sr、87Sr、88Sr四种稳定同位素,具有低温地表迁移过程中不分馏的特性,因此锶同位素是良好的土壤无机碳阳离子物源示踪剂(Dart et al., 2007)。
通过提取成土母质中的硅酸盐与原生碳酸盐组分,分别测试其87Sr/86Sr值,得到两端元锶同位素特征值(Jacobson et al.,2002)。利用成土碳酸盐87Sr/86Sr值,即可利用简单的二端元混合模型得到来自硅酸盐风化Sr的比例(Capo et al., 1998;李富山和韩贵琳,2012;Dietrich et al., 2017)。尽管Sr和Ca具有相似的性质,但Sr和Ca在碳酸盐和硅酸盐中的分配比例却不一样,相比于碳酸盐,硅酸盐中Sr含量明显比Ca含量富集。因此两个端元的Ca贡献不止取决于Sr同位素特征,还取决于碳酸盐端元和硅酸盐端元的Sr/Ca摩尔比,据此可得来自硅酸盐风化Ca的比例,即SPC比例(Capo et al., 1998;Violette et al., 2010;Dietrich et al., 2017)。两式如下:
\begin{split} & \operatorname{Sr}(\%)=\\ & \frac{\left[\left({ }^{87} \mathrm{Sr} /{ }^{86} \mathrm{Sr}\right)_{\mathrm{PC}} - \left({ }^{87} \mathrm{Sr} /{ }^{86} \mathrm{Sr}\right)_{\mathrm{C}}\right]}{\left[\left({ }^{87} \mathrm{Sr} /{ }^{86} \mathrm{Sr}\right)_{\mathrm{PC}} - \left({ }^{87} \mathrm{Sr} /{ }^{66} \mathrm{Sr}\right)_{\mathrm{C}}\right] + \left[\left({ }^{87} \mathrm{Sr} /{ }^{86} \mathrm{Sr}\right)_{\mathrm{S}} - \left({ }^{87} \mathrm{Sr} /{ }^{86} \mathrm{Sr}\right)_{\mathrm{PC}}\right]} \end{split} (9) \begin{split} &\mathrm{Ca}(\%)=\mathrm{SPC}(\%)= \\ & \frac{\left[\left({ }^{87} \mathrm{Sr} /{ }^{86} \mathrm{Sr} \right)_{\mathrm{PC}} - \left({ }^{87} \mathrm{Sr} /{ }^{86} \mathrm{Sr}\right)_{\mathrm{C}}\right] \mathrm{K}_{\mathrm{C}}}{\left[ \left({ }^{87} \mathrm{Sr} /{ }^{86} \mathrm{Sr}\right)_{\mathrm{PC}} - \left({ }^{ 87} \mathrm{Sr} /{ }^{86} \mathrm{Sr} \right)_{\mathrm{C}} \right] \mathrm{K}_{\mathrm{C}} + \left[ \left({ }^{87} \mathrm{Sr} /{ }^{86} \mathrm{Sr} \right)_{\mathrm{S}} - \left({ }^{87} \mathrm{Sr} /{ }^{86} \mathrm{Sr}\right)_{\mathrm{PC}} \right] \mathrm{K}_{\mathrm{S}}}\\ &* 100 \end{split} (10) 式中,(87Sr/86Sr)PC代表次生碳酸盐87Sr/86Sr值,(87Sr/86Sr)C代表成土母质中碳酸盐组分87Sr/86Sr值,(87Sr/86Sr)S代表成土母质中硅酸盐组分87Sr/86Sr值,KC、KS分别代表碳酸盐组分与硅酸盐组分的Sr/Ca摩尔比。
应用该方法,很多学者研究了土壤成土碳酸盐中Ca2+来源,得到了硅酸盐风化释放出的Ca2+在成土碳酸盐中的占比(表3),从中可以看出,硅质成土碳酸盐占比变化范围很大。很多(尤其早期)研究中应用该方法区分得到的硅质成土碳酸盐占比都很低(<10%)。Capo and Chadwick(1999)对美国新墨西哥州拉斯克鲁塞斯附近更新世沙漠土壤以及钙质结砾岩(Calcrete)中的锶和钙的来源进行了示踪研究,发现土壤硅酸盐的风化对土壤钙的贡献不足2%;Chiquet et al.(1999)在西班牙中部得到的比例为2.7%~7.8%;Dart et al.(2007)在澳大利亚中部和南部的风化层碳酸盐中得到的比例约为10%;Huerta et al.(2015)在西班牙两座火山岛的研究也得出了相似的结论。但在最近部分区域的一些研究中也发现了不同的情形。如Naiman et al.(2000)在美国西南部得到39%~58%的成土碳酸盐钙源来自玄武岩母质;Dietrich et al.(2017)在喀麦隆远北地区硅酸盐流域得到成土碳酸盐结核中钙来自硅酸盐基岩原位风化源的比例高达50%以上;而Violette et al.(2010)在南印度成土碳酸盐中也得到了极高的比例—24%~82%(平均55%)。
表 3 基于87Sr/86Sr值估算的不同地区土壤无机碳SPC与CPC占比Table 3. Soil inorganic carbon SPC and CPC shares in different regions estimated based on 87Sr/86Sr values地点 PC钙源/SPC占比 成土母质 文献来源 定
性摩洛哥阿特拉斯 来自降水以及基岩风化 玄武岩 Hamidi et al., 2001 智利阿塔卡马沙漠 沿海地区主要来自海洋气溶胶输入(>50%),
大陆内部主要来自基岩风化岩浆岩+灰岩+碎屑岩 Rech et al., 2003 印度西高止山脉 来自非钙质基岩风化以及风沙 片麻岩+花岗岩+绿岩 Durand et al., 2006 定
量西班牙两座火山岛 极少 岩浆岩+砂岩+风积物 Huerta et al., 2015 美国新墨西哥州 <2% 非钙质冲积物 Capo and Chadwick,1999 西班牙中部 2.7% ~ 7.8% 花岗岩 Chiquet et al., 1999 澳大利亚中南部 ~10% 花岗岩、玄武岩、角闪岩、绿岩、页岩 Dart et al., 2007 夏威夷岛 33% 玄武岩 Whipkey et al., 2000 美国西南部 39~58% 岩浆岩+灰岩 Naiman et al., 2000 印度南部 24%~82% 片麻岩+超镁质岩 Violette et al., 2010 喀麦隆远北地区 >50% 花岗岩+绿岩 Dietrich et al., 2017 注:定性指研究中基于87Sr/86Sr值推断PC的主要钙源,并未得到明确SPC占比的;定量指研究中基于87Sr/86Sr值得出明确SPC占比或来自硅酸岩风化钙源贡献比例的。 事实上,由于硅酸盐风化极其缓慢,大多数地区的硅质成土碳酸盐占比不高,结合年代学结果得到的累积速率普遍很低,这使得在短时期尺度内,其形成过程中所固定的大气CO2量很少。然而,研究发现,当成土作用发生在非钙质母质上并远离海洋气溶胶影响时,钙源主要来自硅酸盐基岩风化,硅质成土碳酸盐广泛形成(Anand et al.,1997;Rech et al.,2003;Lintern et al., 2006;Violette et al.,2010;Dietrich et al.,2017),即使累积速率较低,占比不高,但在全球范围内,以极低的累积速率计算(1 gC m−2 a−1;Schlesinger,1985),硅酸盐母质中形成的土壤碳酸盐每年也可能固存10~23 TgC(Scharpenseel et al., 2000),仍表征了在地质尺度上,土壤无机碳存在真实,且不容忽视的固碳效应。此外,大气沉降钙源贡献也不容忽视,当大气沉降中包含了硅酸盐风化产物时,降落到土壤中,同样具备碳汇作用(Grossman et al., 1995)。
据此,在部分区域土壤无机碳的固碳作用毋庸置疑,而从全球尺度考量,干旱区土壤碳酸盐是否具备真正意义上的碳汇作用,仍需进行大量的研究工作来证实并确定相关贡献率(Schlesinger,2017)。
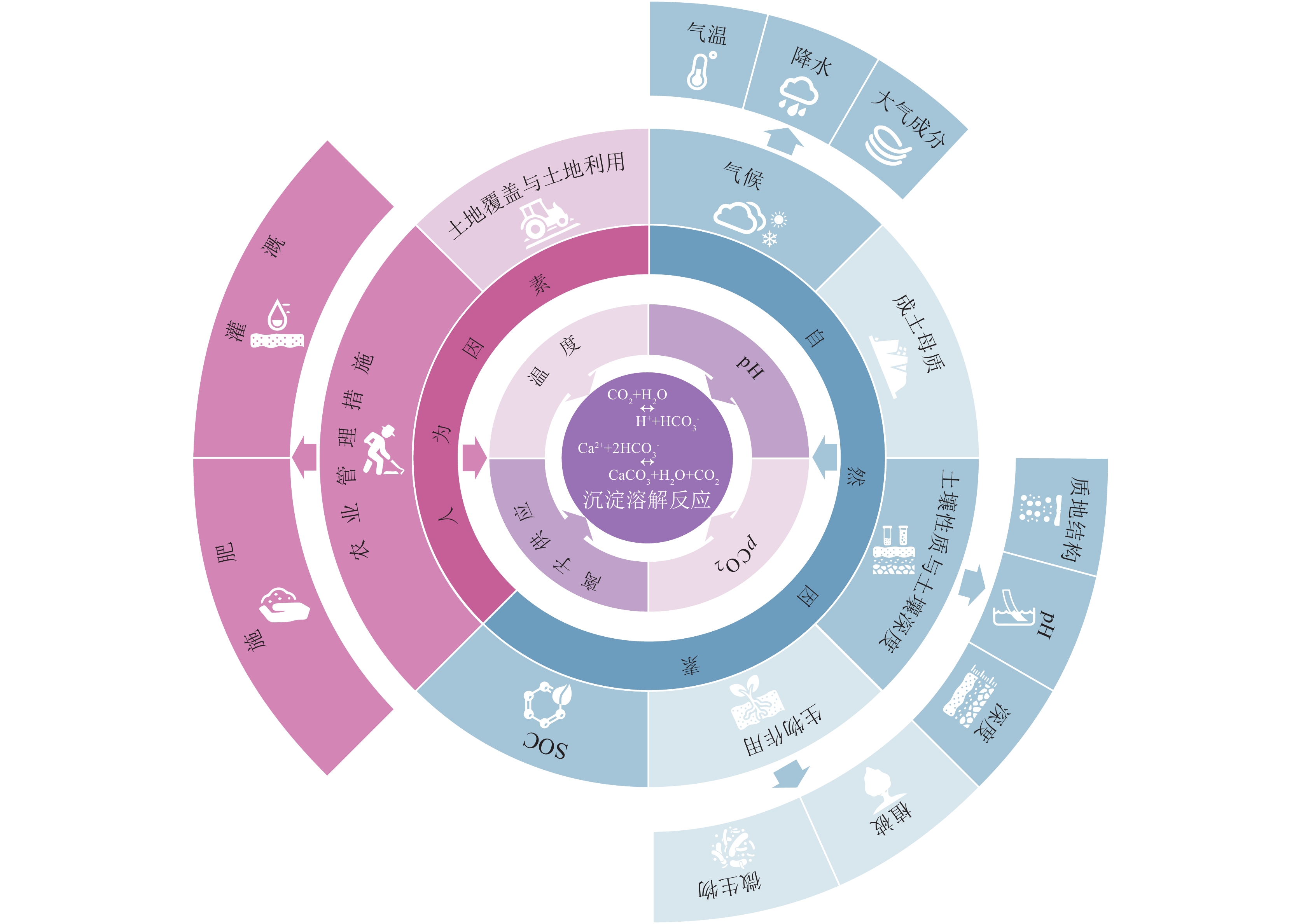
4. 土壤无机碳碳库影响因素
4.1 钙镁碳酸盐沉淀反应与控制因素
土壤无机碳碳库影响因素非常复杂,包含了人为与自然等众多因素,彼此有着复杂的联系与影响(Khalidy et al., 2022),为了厘清相关因素的本质联系,首先需要明确无机碳形成的本质反应—钙镁碳酸盐沉淀反应的过程与控制因素(以钙为例,式(1)、式(2))。
控制该反应进行方向与程度的因素包含了温度、pH、二氧化碳分压(pCO2)以及相关离子供应。
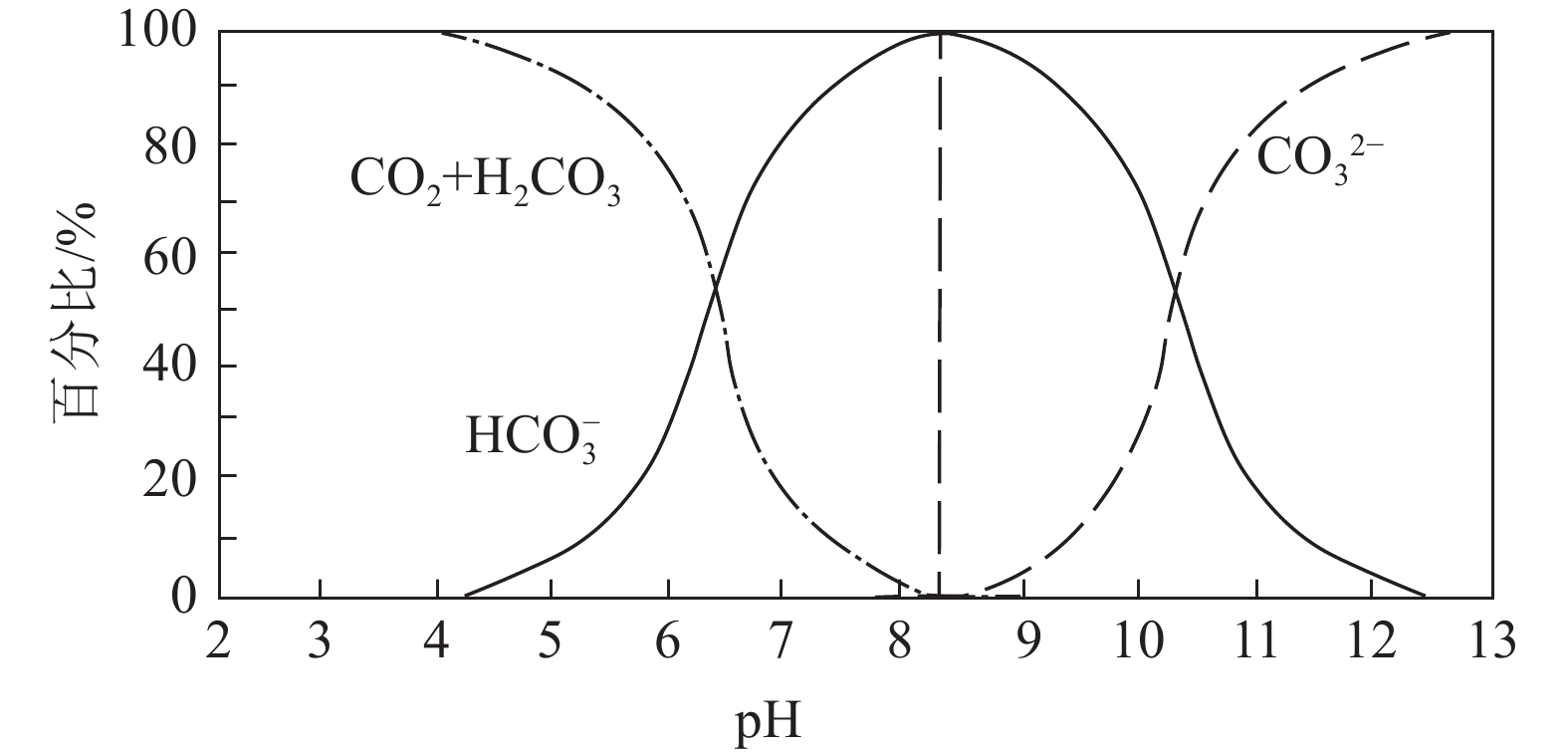
高温会使得反应速度加快,且碳酸钙具有反常的溶解度,温度与溶解度负相关,温度升高时,碳酸钙溶解度下降,促使碳酸盐析出,反应正向进行。pH控制了CO2在溶液中3种离子的浓度比例(H2CO3、HCO3−、CO32−)(图11),当pH值较高时会促使沉淀反应正向进行,反之则逆向进行,大大增加了碳酸盐的溶解度。pCO2与碳酸盐溶解度正相关,pCO2的增大会使得碳酸钙溶解度增大,使得沉淀反应逆向进行,但同时pCO2的增加也会促进土壤CO2的溶解。另外,假如溶液中有着充足的阳离子(Ca2+、Mg2+)与阴离子(H2CO3、HCO3−、CO32−)供应,能保证足够的物质来源与离子浓度,增加水溶液的碳酸盐饱和度,保证沉淀反应的持续进行。总体来说,土壤温度升高,土壤pH值增大、土壤孔隙pCO2减小以及充足的离子供应都会促进碳酸盐的沉淀反应,固定大气CO2,增加土壤无机碳储量,反之则可能阻碍PC的形成甚至消耗现有土壤无机碳库。但值得注意的是,反应过程所带来的碳源汇效应还需仔细考虑离子来源与产物去向,再加以判断。
从本质上,土壤性质、气候、生物作用、成土母质、土地利用与土地覆盖、农业管理措施(灌溉、施肥、耕作)等因素,都是通过影响次生碳酸盐的沉淀与溶解过程的控制因素,从而实现对干旱区土壤无机碳库的形成、分布与封存的影响(图12)。
4.2 影响土壤无机碳形成与分布的自然因素
4.2.1 气候
气候因素包含了温度、降水,越来越多研究揭示了土壤无机碳储量与固碳作用(SIC存量与PC含量)和气候因素高度相关(Wang et al., 2010;Zamanian et al., 2016;Raheb et al., 2017;Du and Gao,2020;图2)。
温度与降水对土壤无机碳的影响可体现在两方面:直接影响碳酸盐沉淀,或者通过影响生物作用(植被覆盖与微生物作用)间接扰动无机碳的形成。
在广泛的温度范围内(从炎热沙漠到寒冷冻土区)都可发生土壤无机碳的固定,形成成土碳酸盐(Zamanian et al., 2016),气温的升高可直接升高土壤温度,并且增加蒸发量,促进碳酸盐沉淀并保存,因此温度与土壤无机碳含量呈正相关(Mi et al., 2008)。与此同时,温度升高会降低CO2溶解度,直接影响土壤溶液中CaCO3的过饱和度(Barker and Cox,2011);但温度升高会促进微生物的呼吸作用,从而增加土壤孔隙的二氧化碳浓度(Lal et al., 1999)。温度的这种生物效应压倒了二氧化碳溶解度的非生物效应,因此,较高的温度增加了成土碳酸盐积累率(Gocke et al., 2011;Zamanian et al., 2016)。并且高温使得成土碳酸盐的累积速率加快,导致引入更多的杂质,如增加了成土碳酸盐结构中的稀土元素(REE)含量(Gabitov et al., 2008;Ma et al., 2010),这种共沉淀物的存在会影响成土碳酸盐形成后的溶解速度,以及其形态和晶体大小(Eisenlohr et al., 1999)。
降水直接影响着土壤水分条件,与土壤无机碳SIC的关系可表现出正相关与负相关两种结果,两者并不冲突。众多研究发现,SIC与年平均降水量(MAP)呈负相关(Mi et al., 2008;Wang et al., 2010;Raheb et al., 2017),这是由于过高的降水会导致土壤无机碳的溶解流失,不利于其保存(Schindlbacher et al., 2019),中国总SIC储量的84%集中在年降雨量小于500 mm的地区(Mi et al., 2008;;Song et al., 2022)。值得一提的是,过高的降水造成的土壤无机碳溶解,仅是将其转化为了溶解无机碳DIC,这些DIC会在土壤剖面上向下淋溶,最终可能在土壤剖面深部重新沉淀,或者转移进入地下水、地表径流等储库,并未直接造成碳库的损失,溶解过程中对大气CO2的吸收甚至反而形成碳汇。但后续可能在某些情况下重新作为CO2返回大气形成碳源,而抵消最初的汇,最终表现为碳中性,也可能稳定存在于某些储库中(如地下水)而形成碳汇(Cole et al., 2007;Li et al., 2015;图13)。而一些研究却显示土壤无机碳(尤其成土碳酸盐PC)伴随降水的增加而增加(Landi et al., 2003;Raheb et al., 2017;Liu et al., 2018),这是由于在干旱半干旱区,限制成土碳酸盐形成的主要因素是过低的土壤含水率,使得缺乏沉淀反应的溶液环境,碳酸根离子的供应受限,因此在一定范畴内,降水量的增加提高了土壤含水量,增加了大气CO2的溶解,有利于成土碳酸盐的形成,有利于形成碳汇(Wang et al., 2010;Liu et al., 2018)。与此同时,降水量的增加可能导致土壤无机碳在垂向空间上的分布改变,使其富集区域向深部转移(Mi et al., 2008;Wang et al., 2010;Yang et al., 2012),在土壤无机碳存量统计深度不足时,结果就可能存在偏差而导致矛盾的结论。
高蒸发量与低降水量并存的干旱半干旱区,导致高蒸发系数(蒸发量/降水量)抑制碳酸盐溶解和浸出,使得干旱土壤富含SIC(Zamanian et al., 2016)。与此同时,伴随温度与降水条件的变化,形成的不同气候带有着不同的植被(自然景观)以及微生物群落,影响着土壤呼吸(pCO2)、离子供应等因素,从而间接影响土壤无机碳储量以及成土碳酸盐固定量(Lal,2004;Mi et al., 2008;Wang et al., 2010)。
4.2.2 大气化学成分
影响土壤无机碳的大气成分包括了大气CO2、SO2、NO2及NOX等气体。由于化石燃料的燃烧,使得大气CO2水平在近几十年显著升高,给全球碳循环带来了深远的变化,这对干旱区土壤无机固碳所产生的影响,与土壤性质、呼吸作用、土壤剖面深度、风化作用、降水量、土壤酸度和施肥等因素共同作用,仍然相当复杂与不确定,并非简单的促进或抑制作用(Ferdush and Paul,2021)。
人类活动导致的硫化物以及氮氧化物的过度排放,将会导致愈发频繁和高强度的酸雨沉降,甚至突破了土壤自身的天然缓冲调节能力,使得土壤pH不断减小,对土壤无机碳库造成了巨大的损失(Markewitz et al., 1998;Oh et al., 2004;Ouyang et al., 2008;Yang et al., 2010;Raza et al.,2021;Song et al.,2022)。Song et al.(2022)在中国的研究显示,从1980年代到2010年代,土壤无机碳总储量减少了(8.99±2.24)%(1.37 ± 0.37 Pg C),Raza et al.(2021)研究了全球土壤酸化导致的CO2流出(7.5 Tg C a−1)和施用石灰(273 Tg C a−1)的无机碳损失,显示了土壤酸化导致的无机碳库损失不容忽视,已成为一个重要碳源。中国各地土壤平均的无机碳损失(0.046 Pg C a−1)和耕地土壤的无机碳损失(0.016 Pg C a−1)分别占陆地碳汇的17.6%~24.0%和耕地土壤有机碳汇的57.1%,推及全球,土壤无机碳损失水平已然危及全球通过SOC固存来缓解气候变化的努力(Raza et al., 2021;Song et al., 2022)。
4.2.3 土壤性质与土壤深度
土壤质地与土壤结构、土壤剖面深度、土壤pH值和土壤溶液的离子强度都会影响土壤SIC的累积和PC的形成(Finneran and Morse,2009;Liu et al., 2014;Zamanian et al., 2016;Du and Gao,2020;Ferdush and Paul,2021;Raza et al., 2021)。
土壤质地和土壤结构控制着成土碳酸盐的积累深度,因为它们影响土壤持水性、孔隙水的渗透和移动(Chadwick et al., 1989)。土壤黏粒组分较多时,微孔数量增加,土壤持水性上升,而砂粒组分增加了土壤大孔隙数量,土壤透气性(Neira et al., 2015)增加,良好的持水性和适当的透气性会促进无机碳的形成,并使土壤无机碳分布到土壤剖面更大的深度上(Ferdush and Paul,2021)。土壤质地和土壤结构随着土壤深度的改变而改变,土壤越深,土壤变得更加紧密,渗透性更差,CO2溶解度和pCO2明显下降,如果存在外源Ca2+、Mg2+,则沉淀出成土碳酸盐,广泛形成钙积层,富集土壤无机碳(Ferdush and Paul,2021)。
干旱半干旱区的国内外众多研究实践也显示了土壤无机碳在剖面上向下增加的趋势(Mi et al., 2008;Tan et al., 2014;Raheb et al., 2017;Du and Gao,2020;表4),80%以上的土壤无机碳可以储存在100 cm以下,50%储存在300 cm以下(Wang et al., 2013a)。例如中国北部内蒙古自治区温带地区的森林、草原、灌木沙漠和荒漠土壤记录了超过一半的土壤无机碳储存在1~3 m深度(Wang et al., 2010;Liu et al., 2014)。并且在一些研究中发现,在类似的农业管理方式、土壤性质和气候条件(即温度和降水)下,土壤无机碳都随深度增加而增加(Landi et al., 2003;Stevenson et al., 2005;Mi et al., 2008;Wang et al., 2015c;Guo et al., 2016;Bughio et al., 2016;An et al., 2019)。
表 4 不同深度土壤中土壤无机碳占比Table 4. Percentage of soil inorganic carbon in soils at different depths研究地点 不同深度SIC分布结论 文献来源 中国 1~3 m储量占比54.9%~88.5% Li et al., 2007 内蒙古 1~3 m储量占比>50% Wang et al., 2010 兰州 1~2 m储量占比50% Zhang et al., 2015 西班牙东南部 1~2 m储量占比51% Dı́az−Hernández et al., 2003 新疆 1 m以下储量占比>80%,3 m以下储量占比>50% Wang et al., 2013a 加拿大萨斯喀彻温省 深层土壤(C层)储量占比几乎100% Landi et al., 2003 内蒙古 0~30 cm、30~100 cm储量占比15%、85% Wang et al., 2013b 黄土高原 0~20 cm、20~50 cm、50~100 cm储量均值2.39、2.92、4.89 Pg Tan et al., 2014 新疆 0~30 cm、30~100 cm密度均值:耕地11.0、30.9 kg C m−2,灌木林地9.8、27.0 kg C m−2 Wang et al., 2015c 青藏高原 0~30 cm、0~50 cm、0~100 cm密度均值5.70、9.10、13.46 kg C m−2 Yang et al., 2010 黄河三角洲 0~20 cm、80~100 cm含量均值为10.48 g∙kg−1、12.72 g∙kg−1 Guo et al., 2016 伊朗西北部 表土平均含量(A层):7.9%;深层平均含量(C层):21.2% Raheb et al., 2017 土壤pH是决定土壤无机碳稳定性的重要因素。在一定范围内,因土壤具有一定的酸缓冲能力,酸沉降、施肥等外源输入一定数量的H+后,土壤仍能保持一定的酸碱度范围,使pH值变化不大。但当有限的缓冲能力被突破后,势必会造成土壤酸化,过量的H+消耗无机碳并向大气释放CO2(Markewitz et al., 1998;Mikhailova and Post,2006;Raza et al., 2021;Song et al., 2022)。尤其在非钙质母质上形成的土壤,酸化会造成可用阳离子的耗竭,进而影响土壤养分与生物有效性(Wang et al., 2015a; Raza et al., 2021)。并且,pH可通过控制土壤溶液中CaCO3的过饱和状态影响碳酸盐晶体的大小和形态,碳酸氢盐/碳酸盐的比例随着土壤的pH值变成碱性(如pH值为8.5)而减少,有利于提高成核率,更快地沉淀出更小的CaCO3晶体(Ma et al., 2010;Zamanian et al., 2016)。
土壤溶液的离子强度控制了CaCO3溶解过程中自由水的分子量(Finneran and Morse,2009)。因此,与无盐土壤相比,盐碱地中的CaCO3溶解所需时间更长,更易发生沉淀(Zamanian et al., 2016)。
4.2.4 生物作用(植被与微生物)
对干旱区土壤无机碳产生影响的生物活动,主要包括了植被(主要由根系参与)与土壤微生物共同参与的土壤呼吸作用,改善了CO2在土壤中的供应,改变了土壤pH与pCO2,总体上促进了PC的形成和SIC的累积。
土壤生物物理模型显示,土壤二氧化碳的总浓度不仅来自大气,而且来自土壤中强烈的生物活动(生物体的呼吸作用)(Andrews and Schlesinger,2001)。植被根系与土壤微生物的呼吸作用产生的生物性CO2使得地下的CO2浓度可能增加近两倍(Cerling, 1984; Amundson et al., 1998),提供了充足的重碳酸根、碳酸根离子,有助于成土碳酸盐的形成(Tamir et al., 2012;Bughio et al., 2016)。
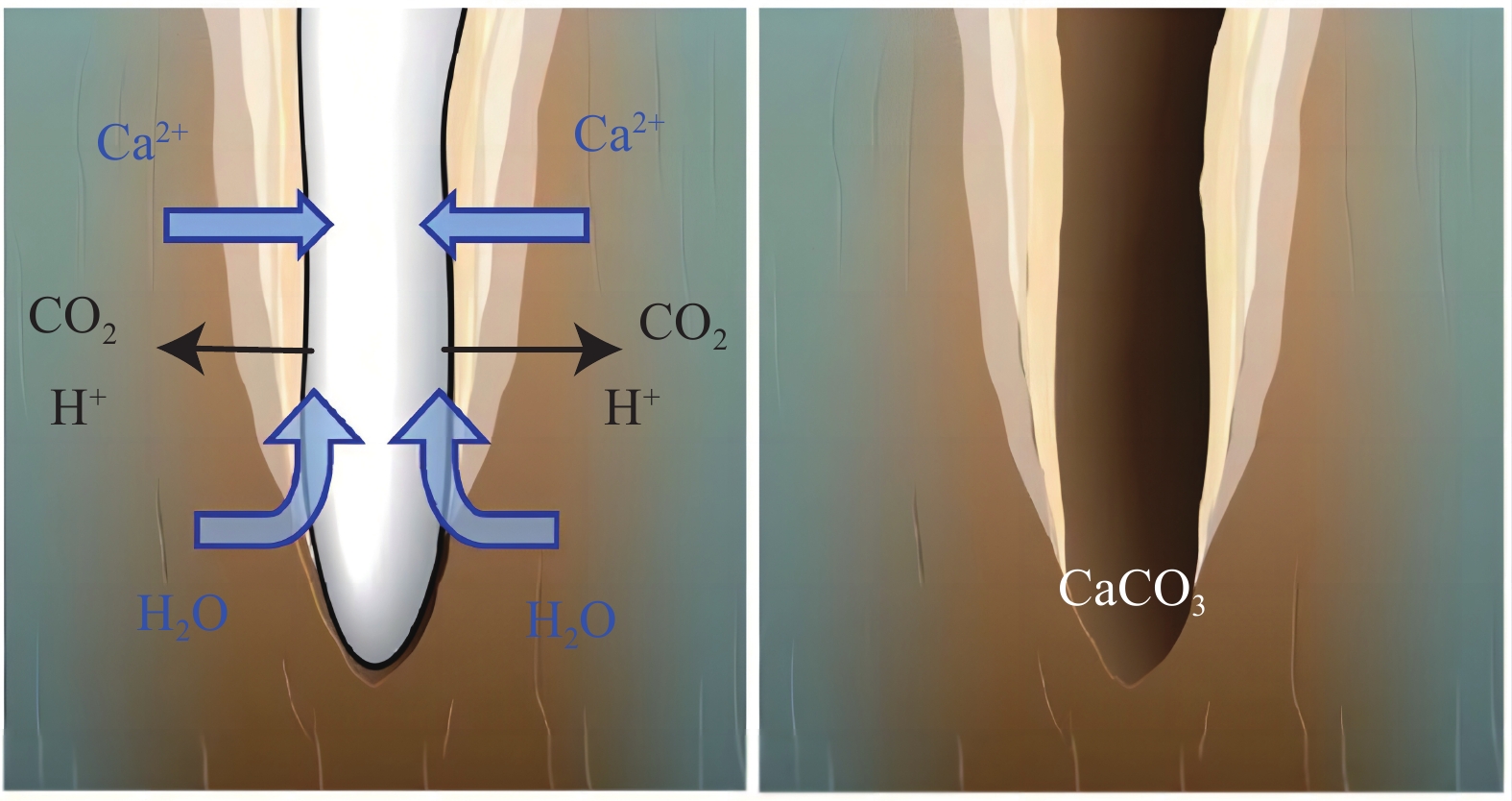
由于植被根系的存在,根瘤中的二氧化碳浓度甚至比大气高了100倍,根系附近因为高pCO2以及根部释放的H+和羧酸增加了CO2在土壤水中的溶解(Berthelin,1988;Andrews and Schlesinger,2001;Gocke et al., 2011)。与无根系的土壤相比,根系对土壤溶液的吸收也会使得Ca2+等阳离子流向根系,较高的离子浓度导致靠近根部的成土碳酸盐积提高了两个数量级(Kuzyakov et al., 2006;Gocke et al., 2011;Zamanian et al., 2016),随根系对水分的吸收,CaCO3过饱和并围绕根系沉淀,在根系死亡和有机组织分解后,甚至形成钙质根石(围绕根系沉淀形成的钙质结壳,图7g和图14)。而这种促进作用的强度与根系的分布密度、深度以及不同物种植被根系在生物作用中释放物质的差异均有联系(Hamada and Tanaka,2001;Kuzyakov and Domanski,2002),导致了不同的植被覆盖下土壤无机碳累积速率与含量存在差异(Mi et al., 2008;Wang et al., 2010)。
![]() 图 14 植物根系促进周围PC沉淀以及钙质根石(Rhizoliths)形成过程示意图(据Zamanian et al., 2016修改)Figure 14. Schematic diagram of the process of PC precipitation surrounding plant roots and formation of Rhizoliths (modified from Zamanian et al., 2016)
图 14 植物根系促进周围PC沉淀以及钙质根石(Rhizoliths)形成过程示意图(据Zamanian et al., 2016修改)Figure 14. Schematic diagram of the process of PC precipitation surrounding plant roots and formation of Rhizoliths (modified from Zamanian et al., 2016)土壤微生物,即细菌和真菌,在成土碳酸盐形成中也很活跃(Monger et al., 1991;Zhao et al., 2020)。微生物不仅会在呼吸作用过程中释放CO2,它们本身在死亡后也会被分解产生CO2,最终导致土壤气体中的高pCO2(Rovira and Vallejo,2008;Tamir et al., 2012;Bughio et al., 2016;Zhao et al., 2020),使得表土中的CO2溶解度增加,形成大量可溶性无机碳向土壤深部运移,并在含水量降低,pCO2降低的过程中沉淀下来(Zhao et al., 2016)。并且微生物(如细菌)可以利用分解过程中产生的有机酸,进一步分解成可溶性无机碳(DIC),从而增加pH值,如果溶液中有Ca2+离子,细菌可以在几天内产生明显的碳酸盐积累(Monger et al., 1991;Braissant et al., 2002;Zhao et al., 2020)
4.2.5 成土母质
土壤无机碳会随成土母质类型和成土过程而变化,主要影响了无机碳形成过程中的离子供应(Yang et al., 2018)。可将成土母质简单分为两类:钙质母质(碳酸盐岩或富含碳酸盐矿物的沉积物等)与非钙质母质(火成岩或非钙质沉积物等)。
钙质母质上发育而成的土壤通常富含成岩碳酸盐,有着较为充足的阳离子供应,利于成土碳酸盐的形成,因此通常容易有较高的土壤无机碳含量以及相应的成土碳酸盐含量(Schlesinger et al., 1989;Dı́az−Hernández et al., 2003)。与此同时成土碳酸盐的δ13C值显示出更高的异质性,这是由于结晶过程中成岩碳酸盐的混入(Kraimer and Monger,2009)。
而非钙质母质上发育的土壤则往往缺乏充足的钙镁离子供应,甚至因为成土碳酸盐的沉淀而耗竭土壤全部的钙(Naiman et al., 2000;Whipkey et al., 2000;Hamidi et al., 2001;Landi et al., 2003),多数情况下需要依靠大气沉降、灌溉等外源输入进行补充,这限制了成土碳酸盐的形成(Violette et al.,2010;Dietrich et al., 2017)。但成土碳酸盐的占比非常高,由于缺少灰岩等钙质母岩,土壤中所累积的无机碳几乎都是次生形成(Whipkey et al., 2000;Rech et al.,2003;Violette et al.,2010)。同时,非钙质母质的风化有助于某些阳离子如稀土元素、铀、钡等作为杂质混入PC晶体中(Violette et al., 2010;Yang et al., 2014),这会抑制成土碳酸盐的溶解,利于成土碳酸盐的后续保存(Eisenlohr et al., 1999)。
另外,钙质与非钙质母质会导致不同的阳离子来源,形成不同比例的SPC与CPC,这影响着SIC形成过程中真正的碳汇强度(表3)。
4.2.6 土壤有机碳(SOC)
土壤SOC与SIC间的关系是复杂的,许多研究得到了不一致的结论,两者的关系可能为正相关(Su et al., 2010;Wang et al., 2014;Wang et al., 2015b, c)、负相关(Huang and Wang,2006;Zhang et al., 2015;Zhao et al., 2016)甚至不相关(Shi et al., 2012;Lu et al., 2020;表5)。这取决于多个因素,如SIC和SOC的来源、土壤性质、气候条件、土地利用变化、管理实践等(Yang et al., 2010;Guo et al., 2016;Lu et al., 2020)。
表 5 不同地区土壤无机碳与土壤有机碳相关性汇总Table 5. Summary of correlation between soil inorganic carbon and soil organic carbon in different regions研究地点 SIC与SOC
相关性结论文献来源 甘肃省河西走廊中部 正相关 Su et al., 2010 以色列贝特谢安 Tamir et al., 2012 内蒙古、西藏 Shi et al., 2012 新疆焉耆盆地 Wang et al., 2014 新疆焉耆盆地 Wang et al., 2015b 新疆焉耆盆地 Wang et al., 2015c 黄河三角洲 Guo et al., 2016 中国河北衢州
黄土高原Bughio et al., 2016
Tong et al., 2020室内实验 负相关 Demoling et al., 2007 宁夏 Liu et al., 2014 兰州 Zhang et al., 2015 云南 Li et al., 2016 黄土高原 Zhao et al., 2016 黑河流域 Yang et al., 2018 青藏高原 Du and Gao, 2020 内蒙古、西藏 不相关 Shi et al., 2012 华北平原 Lu et al., 2020 西班牙巴塞罗那 PC与SOC碳
同位素线性相关,
具备成因联系Rovira and Vallejo,2008 美国华盛顿州 Stevenson et al., 2005 部分情况下,SOC与SIC表现为正相关关系,此类研究往往涉及不同时间节点的对比,由于环境条件的变化而导致了两者协同变化,这表明了SOC与SIC的成因联系,与土壤生物作用相关联。本质上,SOC在土壤微生物的作用下分解矿化,产生CO2进入土壤气或土壤水中,在适宜条件下转化为SIC,两者具备成因联系(Tamir et al., 2012;Bughio et al., 2016)。如Bughio et al.(2016)在河北衢州的研究发现,有机肥的施用促进了生物作用,增强了土壤呼吸作用,增加了土壤成土碳酸盐,并保护了成岩碳酸盐,SOC与SIC表现出强烈的协同作用;Tong et al.(2020)运用偏最小二乘回归(PLSR)发现,在黄土高原沉积区,SOC对沉积地SIC的预测具有重要的正向影响,意味着SOC的增加有助于黄土沉积过程中成土碳酸盐的形成;Wang et al.(2015b)在新疆焉耆盆地发现,在干旱地区将灌木地转变为农业用地,不仅可能导致SOC储量增加,还可能导致SIC储量增加,同样体现了SOC对成土碳酸盐PC形成的促进作用,研究中的碳同位素证据(δ13C)也证实了这一点。
另一情况下,SOC与SIC往往表现为负相关关系,可发现此类研究往往涉及垂向空间上的比较,本质是两者垂向空间分布上的差异与错位,与土壤深度相关。如Du and Gao(2020)在青藏高原、Yang et al.(2018)在黑河流域、Zhang et al.(2015)在兰州黄土剖面的研究均得出结论,随着土壤深度的增加,SOC与SIC含量呈现相反的变化趋势,两者负相关。这一负相关关系很可能是假象,SIC由于淋溶淀积作用,必然导致下层土壤富而表层贫SIC,而SOC则相反,由于下层土壤经历了更长时间的矿化,往往导致下层贫而表层富的特征,因此需要独立看待两者的空间变化关系。
还有一种情况更为复杂一些,此类研究涉及水平空间上的对比,可能表现为正相关、负相关或不相关,这种区别可能反映的是SIC和SOC对不同环境条件的变化做出的不同反应(Naorem et al., 2022)。例如,土壤盐度限制了SOC的积累,因为SOC在土壤高pH下的稳定性较低;另一方面,它增加了土壤中的Ca2+/Mg2+浓度,并促进了SIC的累积,从而在SIC和SOC之间产生了负关系(Demoling et al., 2007)。又如高pH条件下,SOC分解提供的CO2带来的酸度变化被土壤缓冲,并不会造成明显的无机碳溶解,反而提供了充足的可溶性无机碳以供碳酸盐的沉淀,SOC与SIC呈正相关关系(Shi et al., 2012;Guo et al., 2016);低pH条件下则不然,SOC分解进一步加剧了土壤的酸化,反而导致SIC的溶解淋滤,SOC与SIC呈负相关关系(Liu et al., 2014;Li et al., 2016)。
这些相互矛盾的发现表明,SOC和SIC之间的关系是复杂的,这可能是与碳酸盐形成有关的多个过程在时间和空间上解耦的结果(Naorem et al., 2022)。
4.3 影响土壤无机碳形成与分布的人为因素
4.3.1 土地利用与土地覆盖
在不同的土地利用和土地覆盖(Land−Use and Land−Cover,LULC)下,土壤无机碳的存量与空间分布不同(表6)。土地覆盖对土壤无机碳的影响是源于对应的气候条件以及生物作用的不同。由森林−沙漠的不同土地覆盖呈现出不同的气候条件以及生物作用强度的渐变,总体来说呈现逐渐增加的规律。如Wang et al.(2010)在内蒙古发现土壤无机碳的密度呈现如下规律:森林、草原<灌木−草原<灌木沙漠<沙漠;Mi et al.(2008)研究也发现不同土地覆盖类型的SIC含量大小呈现以下顺序:沙漠、草原>灌木丛、耕地>沼泽、森林、草甸。同一土地覆盖类型土壤中SIC也可能由于气候的差异而有所不同,如Liu et al.(2014)调查了中国青海省4个草地的SIC储备,其中温带草原的SIC储存能力最高,高山草甸最低。而土地利用方式的不同也决定着土壤内部与外部环境因素的差异,从而影响土壤SIC(表6)。An et al.(2019)进行的一项荟萃分析表明,各种内部因素(如pH值、土壤湿度、有机质含量)和环境(如年均温、降雨量)因素在各种土地利用变化的情况下影响(积极或消极)SIC库。
表 6 土地利用类型变化与不同土地覆盖对SIC的影响Table 6. Effect of land use type change and different land cover on SIC研究地点 研究结论 文献来源 黄土高原 耕地−草地:SIC减少 Liu et al., 2014 美国南部阿根廷潘帕斯草原 自然土地−灌溉耕地,SIC减少 Kim et al., 2020 俄罗斯库尔斯克 自然土地−灌溉耕地:SIC增加 Mikhailova and Post, 2006 新疆焉耆盆地 Wang et al., 2015b 新疆焉耆盆地 Wang et al., 2015c 美国西北部蛇河平原 Entry et al., 2004 中国 Wu et al., 2009 美国西南部 Nyachoti et al., 2019 新疆塔里木盆地 干旱盐碱地−灌溉耕地:SIC增加 Li et al., 2015 甘肃省河西走廊中部 沙地−灌木、林地、耕地:SIC增加 Su et al., 2010 华北平原 普通耕地−集约化种植耕地:SIC增加 Lu et al., 2020 综述 草地−耕地:SIC增加;沙地−林地:SIC增加;草地、耕地−林地:SIC减少 An et al., 2019 黄土高原 SIC密度:农田=草地>森林 Tan et al., 2014 中国 SIC密度:沙漠、草原>灌木丛、耕地>沼泽、森林、草甸 Mi et al., 2008 内蒙古 SIC密度:沙漠>灌木沙漠>灌木−草原>森林、草原 Wang et al., 2010 中国西北部黑河流域 SIC密度:温带草原>高山草甸 Yang et al., 2018 LULC变化会引起土壤SIC库的变化,从而导致碳源或碳汇效应(Mikhailova and Post,2006;Wang et al., 2015c;An et al., 2019;Nyachoti et al., 2019)。An et al.(2019)研究发现,在从草原到农田,以及从沙地到林地的LULC转换中观察到了SIC的积累,而在某些情况下,从农田到草原的转换导致了相反的关联性。说明LULC的转变所导致的SIC库的变化协同了各类因素,在不同情况下有所差异,其源汇效应需要结合实际谨慎判断。而尤其自然土地与人为用地(主要为耕地)间的土地利用变化普遍发生,会导致较明显的SIC变化。有的导致了PC形成以及SIC的增加,如Nyachoti et al.(2019)指出,与干旱环境中的自然土壤相比,将其转变为农田时,成土碳酸盐的积累率较高;Wang et al.(2015c)同样报道了焉耆盆地的半干旱耕地中,灌木林地转为耕地后,对0.87 t C ha−1 a−1的吸收量有贡献。有的则不然,如Kim et al.(2020)观察到,由于土地利用变化为农田,SIC库出现了损失,这可能是因为灌溉导致了农田中碳酸盐的浸出。这些变化都与人为的农业管理措施所带来的影响息息相关。
4.3.2 农业管理措施
(1)灌溉
灌溉活动对土壤SIC的形成与分布影响极大,其与降水相似,直接影响着土壤的水分条件,不同之处在于降水以相对稳定的状态影响着土壤无机碳的长期累积,而灌溉可在短期内彻底扭转土壤水分与生物活动等条件,且灌溉水携带提供了大量离子(Ca2+、HCO3−),这一人类活动所带来的影响,可造成土壤无机碳含量和分布的巨大变化,尤其与排水系统结合时,甚至代表了土壤生物地球化学功能的根本转变(Sanderman,2012;Bughio et al., 2016;Wang et al., 2016;Nyachoti et al., 2019)。
灌溉对土壤SIC的影响也存在不同的结果,一来与降水因素相同,土壤水分变化带来的SIC变化本身即存在正相关与负相关两种情形,在干旱区适当的含水量增加才会带来土壤无机碳含量的增加。大量的灌溉水带来了湿润的土壤环境,提供了溶液环境,加强了生物活动使得pCO2升高,并带来了充足的离子供应,增加了成土碳酸盐形成与土壤无机碳累积(表7)。Entry et al.(2004)在美国西部的研究发现,经过30多年的灌溉种植,1 m深度土层的SIC含量比原生植被下的土壤SIC含量高出(51±11) Mg C ha−1 ;Wu et al.(2009)根据中国第二次全国土壤普查剖面数据研究发现,中国西北灌溉区土壤SIC含量增加了约10%。而Bughio et al.(2016)在河北衢州通过39年不同条件的耕作灌溉土地与自然休耕土地的对比,显示灌溉田地成土碳酸盐PC增加27~33 Mg C ha−1,PC形成的最大潜力取决于灌溉水提供的Ca2+和Mg2+的可用性;Nyachoti et al.(2019)在美国西南部旱地的研究也支持了这一结论,灌溉苜蓿田中的PC更年轻,PC形成速率更高,这一高速率是由农田灌溉引起的高钙和碳通量支持的。
表 7 灌溉对土壤SIC的影响及可能原因总结Table 7. Summary of the effect of irrigation in soil SIC and possible causes相关性 可能原因 相关文献 研究地点 正相关 灌溉提供溶液环境,加强生物活动,
输入钙镁离子以及DIC,促进PC形成Wu et al., 2009 中国 Zhang et al., 2015 兰州 Bughio et al., 2016 河北衢州 Entry et al., 2004 美国西北部蛇河平原 Li et al., 2015 新疆塔里木盆地 Wang et al., 2016 美国新墨西哥州 Nyachoti et al., 2019 美国西南部 负相关 低EC(碳酸钙不饱和)的大量灌溉
水易造成SIC溶解流失Wu et al., 2008 加利福尼亚 Schindlbacher et al., 2019 德国拜罗伊特市 Kim et al., 2020 美国南部大平原,
阿根廷潘帕斯草原二来与降水不同,由于灌溉水携带着大量离子,灌溉带来的影响与灌溉水的CaCO3饱和程度以及土壤碳酸钙浸出率息息相关。高电导率(EC)的灌溉水中碳酸钙处于饱和状态,其碳酸钙浸出率极低,灌溉水提供了充足离子来源的同时避免了SIC的溶解流失,使得SIC含量增加;与之相对,低电导率(EC)的灌溉水中碳酸钙为不饱和状态,碳酸钙浸出率较高,带来的SIC溶解损失将抵消土壤含水量增加所带来的SIC含量增加,甚至造成SIC含量的净下降(Wu et al., 2008;Sanderman,2012;Schindlbacher et al., 2019;Kim et al., 2020;表7)。Wu et al.(2008)的研究对此提供了证据支持,在两个用高盐度水(高EC)灌溉的耕地上,1 m以下的SIC存量比原生植被下的存量大3600 g C m−2,平均年增加率为(42±5) g C m−2 a−1;而在附近的山谷中,灌溉水的EC值很低,SIC储量的变化很小且不稳定,与原生植被下的土壤相比,灌溉时间最长(55年)的土壤顶部一米处的SIC损失了43%(Wu et al., 2008)。
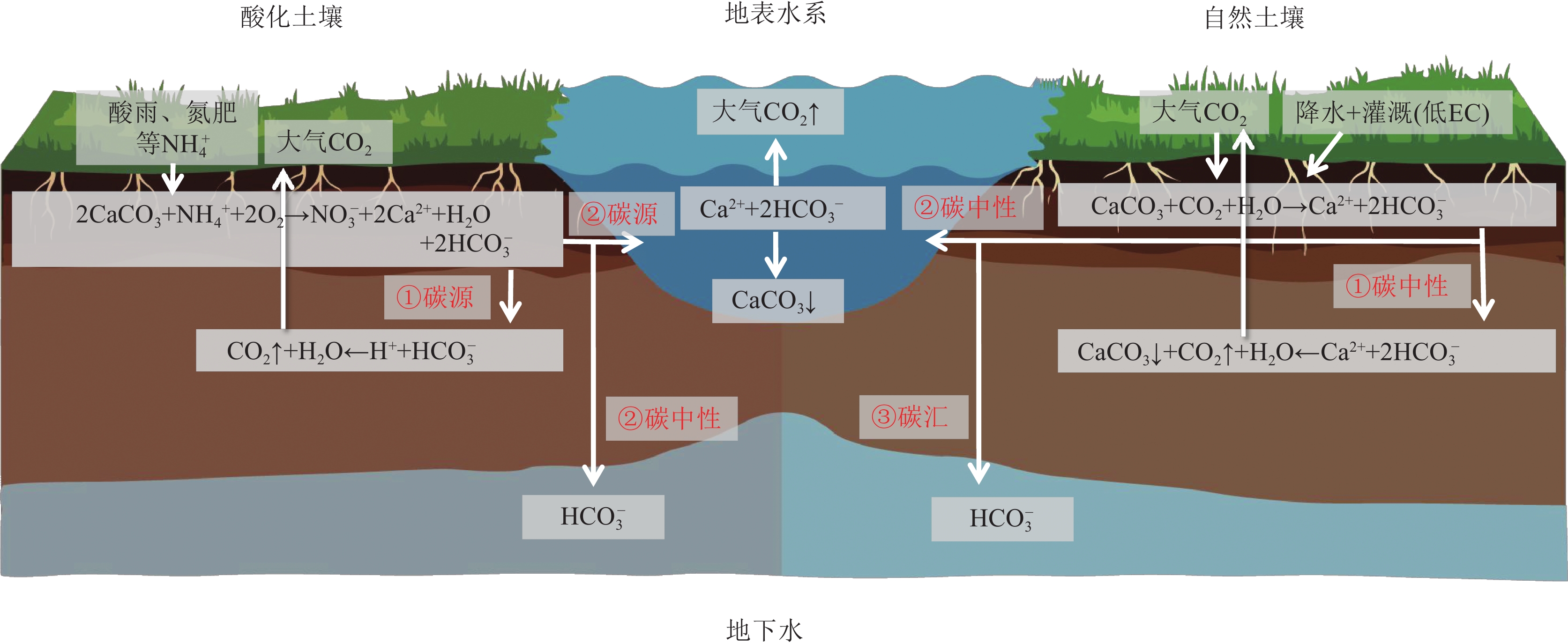
如果灌溉导致表层土壤中的SIC含量降低,为了明确碳源汇效应,需要研究所产生的确定的可溶性无机碳DIC的去向与命运,这可能导致耕地土壤无机碳形成碳源、碳汇或碳中性(图9)。如果所产生的DIC运移至土壤剖面的深处重新沉淀,那么这个过程是碳中性的,只是在土壤剖面上重新分配而已(Sanderman,2012);如果DIC从土壤中被浸出,并进入一个稳定碳库(即地下水或海洋),那么这将是一个净碳汇(Ma et al., 2014;Li et al., 2015);如果HCO3−进入地表水系统,例如通过暗管或沟渠排水进入河流,那么水体中的CO2释放可能会增加,从而抵消了最初溶解过程中土壤系统中发生的部分或全部碳封存,甚至形成碳源(Sanderman,2012;López−Ballesteros et al., 2017;Kim et al., 2020)。
值得注意的一个问题是,在中国乃至世界范围内,抽取地下水进行耕地灌溉十分常见,尤其是在干旱半干旱区。这就导致了一种与DIC进入地下水封存正相反的情况—当灌溉水来自地下水时,可能会使富含了大量DIC的地下水从封闭系统转移至开放系统,而导致大量的CO2脱气,成为碳源。据Schlesinger估计,在水文系统中,每使用1 m3的地下水(40 mg Ca/L)将释放12g C m−2 a−1的CO2(Schlesinger,2000),这也是灌溉所带来的不可忽视的影响。
(2)施肥
施肥是在低肥力、退化的土地上进行作物生产的基本管理策略之一,尤其氮肥,在集约型农业管理中十分常见,但正如前述,导致土壤酸化的因素不止酸雨,还包括了过度施用氮肥。不当的化肥施用导致了土壤酸化,而进一步在世界范围内造成了巨大的土壤无机碳损失和碳排放,也是生态系统可持续发展的主要全球威胁之一(Zamanian and Kuzyakov, 2019;Raza et al., 2021)。
氮肥(有机或无机)通过硝化作用转化为氧化状态的氮,并释放H+(式11),即使在没有硝化作用的情况下,氮肥也会产生酸化,通过交换H+直接被根系吸收(式12)。这导致了土壤酸化,为了缓冲酸度,土壤中的碳酸钙被溶解,以中和H+,并释放CO2(式13)(Marchant et al., 2015;Raza et al., 2020;Zhao et al., 2020;Ferdush and Paul,2021)。
\qquad\qquad\;\;\;\mathrm{NH}_4{ }^{+}+2 \mathrm{O}_2 \rightarrow \mathrm{NO}_3{ }^{-}+\mathrm{H}_2 \mathrm{O}+2 \mathrm{H}^{+} (11) \mathrm{CaCO}_3+\mathrm{H}^{+} \rightarrow \mathrm{Ca}^{2+}+2 \mathrm{HCO}_3^{-}\;\;\;\, (12) \mathrm{H}^{+}+\mathrm{HCO}_3^{-} \rightarrow \mathrm{CO}_2 \uparrow+\mathrm{H}_2 \mathrm{O}\;\;\;\; \;\;\; (13) 在自然情况下,无机碳与溶解的二氧化碳的反应是可逆的,SIC的溶解反而捕获大气CO2成为一个临时碳汇(Sanderman,2012)。而当土壤发生酸化且程度较低,尚在缓冲能力范围内时,假如土壤单纯通过CaCO3的溶解中和酸化,则暂时不会造成额外的碳排,产物以DIC(HCO3−)的形式存在,当DIC进入稳定碳库时(地下水等)为碳中性;假如DIC在剖面深处或地表水系统中重新沉淀,则会放出CO2,形成碳源(Zamanian et al., 2018)。而伴随酸化程度的加强,pH值不断降低,单纯的CaCO3溶解无法完全中和酸化,HCO3−将进一步与H+结合向大气释放CO2,直接形成碳源(Hamilton et al., 2007;Zamanian et al., 2018;图9)。
伴随土壤酸化造成的SIC损失量是不容忽视的。Zamanian et al.(2018)通过解释美国农业部的全球氮肥和CaCO3分布图,计算出干旱和半干旱区通过这一过程排放了7.48 × 1012 g C a−1,即全球范围内化石燃料燃烧排放3%的CO2或土地利用变化排放的30%的CO2,全球在过去的50年中,至少有0.41Gt C以二氧化碳的形式从农业土壤中不可逆转地释放到大气中,并且预估在2050年之前还会有0.72Gt C被释放(Zamanian et al., 2021)。而在中国,Raza et al.(2020)首次对中国农田因氮诱导的土壤酸化而造成的无机碳储量损失进行了估计,土壤0~40 cm厚土层的无机碳储量的7%(0.15 Pg C;1.1 Mg C/ha)在1980年至2020年间流失,700万 ha的农田已经不含碳酸盐,且假如土壤酸化的趋势没有得到遏制,在2100年之前,中国可能会损失另外37%的SIC储量,3000万 ha农田(37.8%)将完全流失土壤无机碳,Song et al.(2022)的研究结果也显示,到2100年19.12%~19.47%的土壤无机碳存量将进一步丧失。这些研究仅统计了表层土壤的无机碳变化,事实上不止表层土壤无机碳受到影响,氮肥也会通过质子的移动导致深层土壤酸化,引起深层土壤中的无机碳损失(Rengel,2003)。
此外,土壤无机碳的损失不仅会造成直接的碳排放问题,扰乱了土壤碳酸盐平衡,还会对土壤化学、物理、微生物和生产力产生若干影响(Raza et al., 2020)。首先,它降低了土壤的缓冲能力,导致盐基阳离子(Ca2+、Mg2+、K+和Na+)的浸出,甚至完全耗竭(Hoegberg et al., 2006;Lucas et al., 2011);此外,它还会降低土壤团聚体的稳定性,导致土壤的质地、透气性与透水性变差(Fernández−Ugalde et al., 2014),进一步影响土壤养分的利用、土壤微生物活动和群落结构的健康(Rousk et al., 2010);同时,土壤无机碳的损失也会引起土壤酸化,提高土壤重金属的生物活性,从而加剧重金属向植物的转移(Wang et al., 2015a),引发生态事件。这些都会反过来间接、不断地导致土壤SIC与SOC的进一步流失。
5. 土壤无机碳与固碳减排意义
目前,全球干旱区面积为66.7 M km2,占地球陆地面积的45.36%(Lal,2019),干旱区2 m深度的无机碳储量估计达到了(1237±15) Pg(Zamanian et al., 2021),使得干旱—半干旱区土壤无机碳碳库成为全球碳库举足轻重的组成部分(图2)。
当前中国的西北干旱区面积2.35×106 km2,约占全国总面积的24.5%,而整个干旱半干旱区从中国西部到东北部,跨越了整个新疆、甘肃、内蒙古、西藏、青海,黑龙江、辽宁和吉林的西部,以及河北、陕西、山西、宁夏的北部区域,面积约4.61×106 km2,更是占到国土总面积的近一半(易成功,2022)。而西北地区无机碳密度平均值(180 cm)为29.37 kg/m2(夏学齐等,2018),干旱区更有占比巨大的2 m以下土壤的无机碳储量未大范围探明,即使在不计算1.8 m以下土壤的巨大无机碳储量的情况下,中国干旱半干旱区无机碳储量仍达到了135.4 Pg,即16.25 Pg C。巨大的干旱区面积和庞大的无机碳储量决定了中国土壤无机碳碳库必须得到重视。
不仅碳库总量巨大,其中在历史时期已固定的大气二氧化碳量(以成土碳酸盐PC、硅质成土碳酸盐SPC计算)同样庞大。目前中国现有研究中,干旱区常见的几种土壤类型的PC所占比例不同,范围为1.33%~35.7%(李杨梅等,2018),PC所固定的大气碳为0.216~5.8 Pg C。而更进一步探寻具备真正固碳意义的SPC储量,按照全球不同地区2%~82%的比例进行计算(表3),中国干旱区无机碳最低储量为4.32 Tg C,最高储量达177 Tg C。在这些计算中,即使以最低范围计,干旱区土壤无机碳碳库与碳汇效应对中固碳减排的贡献与“双碳目标”的实现都意义重大。
更重要的是,在近几十年的研究中,已经有证据表明,通过适当的农事活动以及土地利用类型的转变可以有效增加土壤中的无机碳储量。人为的灌溉与耕种可能在数十年中固定27~51 Mg C ha−1的大气CO2,甚至以高达42~87 g C m−2 a−1的速率固碳(Entry et al., 2004;Wu et al., 2008)。据统计,2000—2020年西北干旱区由未利用地等土地利用类型转入耕地的面积为4.49×104 km2(韩敏等,2022),由此计算,每年由新增耕地所引起的土壤无机碳汇可达到1.89~3.92 Tg。
干旱区无机碳的固碳减排贡献已毋庸置疑,中国广袤的干旱区土壤无机碳研究应当引起高度重视,在当前碳达峰与碳中和目标的驱使下,这一巨大体量的碳库的轻微改变都有着重大的固碳减排意义。
6. 问题与讨论
伴随全球科学家对土壤无机碳研究的逐步深入,干旱半干旱区土壤无机碳对全球碳循环的重要性已毋庸置疑。随着荒漠CO2负通量问题引起研究的热潮,至今二十余载各国研究成果颇丰,明确了荒漠区负通量的形成机理、量级、储库,并将研究焦点与难点集中在了土壤无机碳来源分辨,碳汇作用强度确认与固碳潜力量化,以及影响因素明确与人为干预的可能性评估之上。
目前,关于干旱区土壤无机碳汇效应,土壤碳酸盐,特别是成土碳酸盐在碳的吸收过程中扮演的角色十分复杂。因为土壤碳酸盐的形成涉及到诸多相互联系和影响的因素,包括硅酸盐矿物和碳酸盐矿物的风化,不同条件下的固碳过程以及无机碳在各储库中的流转转化等。这导致要想了解土壤无机碳库组成以及成土碳酸盐形成过程中的碳汇作用,必须辨明相关储库的比例与储量,从区域乃至大陆空间尺度以及从短期(a)至长期(Ma)时间尺度,对整个固碳过程进行系统性考虑,尤其注意对土壤无机碳的来源识别与成因辨析,为结论提供足够的证据支撑。而土壤无机碳循环存在多个空间尺度,如全球尺度、区域尺度(干旱—半干旱区、湿润—半湿润区等)、局域尺度、剖面尺度等,在不同空间尺度上的土壤无机碳循环应当对应了不同的时间尺度,这一时空尺度的对应关系在目前尚未有明确的结论,而关于干旱—半干旱区土壤无机碳循环所对应的周转时间,在后续的研究中也需要得到重点探讨。
而对土壤无机碳成因来源的识别有赖于包括碳、锶在内的相关同位素工作,颇具难度,研究方法仍需完善,研究成果也局限于少数区域,不同区域得出的结论存在矛盾之处,需要更广泛的实践与应用检验。因此,在未来的研究中,对于SIC在全球范围内是否具备真正固碳作用的争议,需要在更广阔的区域范围内展开无机碳来源识别研究以及SPC比例明确,依据充分的数据支撑展开讨论与判断。而全球范围的PC与SPC储量估算、土壤无机碳汇强度估算也离不开这一点。同时在储量估算中,往往忽略了液相储库的估算,目前也缺乏全球性的数据。针对不同来源的土壤无机碳以及不同类型的无机碳储库,期待在世界范围内有更多地区投入到相关研究中,进而进行全球干旱区无机碳汇大小估算,具备重要的科学意义与现实意义。同时,新的同位素技术手段正在不断发展,例如钙同位素的应用范围正在扩大,是否可以利用钙同位素等准确直接示踪成土碳酸盐中Ca的来源,定量硅质成土碳酸盐比例,值得深入研究。
土壤无机碳形成的影响因素同样需要更大量的研究,来寻求更为普适的结论。并且在研究中,SIC的影响因素相当多,包括气候、土壤性质与深度、生物作用、成土母质、土壤有机质、土地利用与土地覆盖、农业管理措施等。这些因素的作用关系复杂,需要系统性考虑,尤其注意自然因素内部各因素之间,以及自然因素与人为因素之间的协同作用关系,来为人为调控的方向和强度提供参考。与此同时,更要注意不能忽视对相关关系背后的影响机制的探究与明确,才是影响因素研究真正推进的基础。开发一个基于机制的模型,预测土壤剖面中的PC积累上限和最大深度,对于理解土壤SIC固碳过程影响因素、施肥和灌溉管理调控作用以及估算SIC固碳潜力来说,也许是非常重要的研究方向,可惜目前并未有相关成果的报告。
此外,本文主要探讨了以碳酸钙为代表的干旱区土壤无机碳源汇效应,实际上,碳酸盐的溶解和沉淀,除了CaCO3,还包括MgCa(CO3)2和FeCO3等。这些土壤非CaCO3的碳酸盐(即使占比较小)在土壤无机碳中的源汇过程研究中也值得关注,例如白云石(MgCa(CO3)2)溶解过程中会释放Mg2+,其很难沉淀形成碳酸盐,因此其应为碳源,类似的例如菱铁矿(FeCO3)和高镁方解石、菱镁矿等,都与CaCO3的地球化学行为存在一定差异。它们的碳源汇角色也应当进行明确。
而在中国,干旱—半干旱区面积约为456万km2,占中国陆地面积的47%,土壤无机碳库碳汇作用的明确意义重大,土壤无机碳领域的相关研究却较少,多数研究集中于新疆塔里木盆地、宁夏毛乌素沙漠与内蒙古草原,尤其依据锶同位素展开的无机碳来源识别研究以及硅质成土碳酸盐比例明确存在研究空白。中国广泛的西北干旱半干旱区亟需中国学者们填补研究空缺。
本次综述详细梳理了全球对于干旱区土壤无机碳及其碳汇效应的相关研究内容,以期为国内外土壤无机碳的进一步研究提供理论参考。土壤无机碳的进一步研究仍然任重而道远,它的重要性却要求我们不可止步。各研究人员的成果致力于明确干旱区土壤无机碳在全球表生碳循环中的重要储库地位和源汇作用,这将为实现土壤无机碳通过人为调控固碳增汇打下理论基础,也将对全球碳中和目标达成、气候变化减缓产生重大意义。
7. 结 论
(1)干旱区土壤无机碳汇作用伴随着干旱区CO2负通量研究得到确认,其碳库组成复杂,包括了液相碳库与固相碳库。其中液相储库主要以可溶性碳酸盐(DIC)形式赋存于干旱区地下水体;固相储库则为土壤剖面上的固相碳酸盐矿物(SIC),依据不同成因来源分为成岩碳酸盐(LC)与成土碳酸盐(PC),后者又细分为碳质成土碳酸盐(CPC)与硅质成土碳酸盐(SPC)。其中SPC形成时的钙镁离子来源于硅酸岩风化,形成过程造成了CO2净吸收,提供了净碳汇,具备真正长期稳定的碳汇作用。
(2)干旱区无机碳汇作用的明确和碳汇大小的估算,必须基于碳、锶等同位素技术进行成因来源识别,研究方法需进一步完善,在世界范围内各地研究结果差异较大,需要更广泛的实践与应用检验,为全球无机碳碳汇以及固碳减排潜力估算提供依据,与此同时不能忽略液相储库的贡献。
(3)无机碳汇的影响因素包括了自然因素:气候、土壤性质与深度、生物作用、成土母质、土壤有机质等;人为因素:土地利用与土地覆盖、农业管理措施等。因素间的作用关系复杂,自然因素内部各因素之间,以及自然因素与人为因素之间存在协同作用关系,研究时需结合研究区特点进行系统性考虑,并关注影响机制的探究与明确,为土壤无机碳实现通过人为调控固碳减排增汇打下理论基础。
(4)干旱区土壤无机碳对全球固碳极其重要,在实现双碳目标的驱动下,全球范围,尤其是干旱—半干旱地区,查清土壤无机碳源汇与影响因素必将是未来一段时间的研究热点,成为解决“碳失汇”科学难题的突破点,极大地推动全球碳循环研究。
-
图 1 全球碳库与碳失汇示意图(据Lal,2019;Naorem et al., 2022修改)
Pg=1015g;人类通过化石燃料排放CO2进入大气的量约5.4 Pg C a−1,破坏森林排放进入大气的量约1.6 Pg C a−1,海洋吸收大气CO2的量约 2 Pg C a−1,大气CO2增加的量约3.3 Pg C a−1,这之间存在着−1.7 Pg C a−1的差值,即5.4 Pg +1.6 Pg −2 Pg −3.3 Pg =1.7 Pg,这部分CO2去向不明,故被称为碳失汇(据方精云和郭兆迪,2007)
Figure 1. Schematic diagram of global carbon pool and missing carbon sink (modified from Lal, 2019; Naorem et al., 2022)
Pg = 1015g; there is a difference of −1.7 Pg a−1 between human CO2 emissions into the atmosphere through fossil fuels of about 5.4 Pg a−1, forest destruction emissions into the atmosphere of about 1.6 Pg a−1, ocean absorption of atmospheric CO2 of about 2 Pg a−1, and increase in atmospheric CO2 of about 3.3 Pg a−1, which is 5.4 Pg + 1.6 Pg − 2 Pg −3.3 Pg =1.7 Pg, and this part of CO2 goes to an unknown destination, which is called missing carbon sink (modified from Fang Jingyun and Guo Zhaodi, 2007)
图 2 全球土壤无机碳密度分布图及其与年平均降水量低值区的相关性(据Zamanian et al., 2016修改)
Figure 2. Global soil inorganic carbon carbon density distribution map and its correlation with the low annual mean precipitation area (modified from Zamanian et al., 2016)
图 3 荒漠土壤CO2负通量的对比实验验证(据Ma et al., 2013修改)
Figure 3. Comparative experimental validation of negative CO2 fluxes in desert soils (modified from Ma et al., 2013)
图 6 塔里木盆地土壤无机碳液相储库DIC淋溶传输(据Li et al., 2015)
a—DIC淋溶传输示意图;b—DIC14C测年年龄等值线图;c—塔里木盆地边缘至中心的地下水DIC年龄
Figure 6. DIC leaching transport of soil inorganic carbon liquid phase reservoirs in the Tarim Basin (after Li et al., 2015)
a−Schematic diagram of DIC leaching transport; b−DIC14C dating age contour map; c−DIC age of groundwater from the edge to the center of the Tarim Basin
图 7 景观与剖面尺度中原生碳酸盐与次生碳酸盐赋存形态区别
a—成岩碳酸盐景观与剖面照片,包含灰岩地层原位风化的LC以及冲积搬运的LC碎屑(Monger et al.,2015);b、e—剖面上的PC钙质菌丝体与胶膜(Zamanian et al.,2016;达佳伟,2020);c、f—剖面上的PC钙结核(Zamanian et al.,2016;达佳伟,2020);d—剖面中的PC层状钙板(达佳伟,2020);g—黄土中的PC钙质根石(Zamanian et al.,2016)
Figure 7. Difference between primary and secondary carbonate fugacity patterns in landscape and profile scale
a−Photos of mafic carbonate landscapes and profiles containing in situ weathered LC from tuff strata and alluvially transported LC debris (Monger et al., 2015); b, e−PC calcareous mycelium with colloidal film in profiles (Zamanian et al., 2016; Da Jiawei, 2020); c, f−PC calcium nodules in profiles (Zamanian et al., 2016; Da Jiawei, 2020); d−PC laminated calcium plates in the profile (Da Jiawei, 2020); g−PC calcareous rhizoliths in the loess (Zamanian et al., 2016)
图 8 微观尺度中原生碳酸盐与次生碳酸盐赋存形态区别
a—钙结核土壤基质中混入的LC颗粒(刘恋等,2010);b—含海洋化石的LC颗粒(Monger et al.,2015);c—钙结核内部PC,包括分布于土壤孔隙中的亮晶方解石以及土壤基质中的泥晶方解石(达佳伟,2020);d—土壤孔隙璧上的PC钙膜(Zamanian et al.,2016);e—钙结核中围绕原生石英及长石颗粒生长的PC(达佳伟,2020);f—假菌丝体中的针状方解石(Monger et al.,2015);g—镜下PC结核以及碎屑表面PC钙膜(Zamanian et al.,2005);h—钙化根,可见细胞结构(Zamanian et al.,2016);i—蚯蚓球晶,正交偏光下(Zamanian et al.,2016)
Figure 8. Difference between primary and secondary carbonate fugitive morphology in microscale
a−LC particles mixed in the soil matrix of calcium nodules (Liu Lian et al., 2010); b−LC particles containing marine fossils (Monger et al., 2015); c−PC inside calcium nodules, including leucocrystalline calcite distributed in soil pores and mud−crystalline calcite in the soil matrix (Da Jiawei, 2020); d−PC calcium film on soil pore jams (Zamanian et al., 2016); e−PC growing around primary quartz and feldspar grains in calcium nodules (Da Jiawei, 2020); f−Nneedle−like calcite in pseudomycorrhiza (Monger et al., 2015); g−Microscopic PC nodules as well as PC calcium films on the surface of debris (Zamanian et al., 2005); h−Calcified roots with visible cellular structures (Zamanian et al., 2016); i− Earthworm spherical crystals, under orthogonal polarization (Zamanian et al., 2016)
图 9 不同来源成土碳酸盐风化与固碳过程示意图(据Monger et al.,2015修改)
Figure 9. Schematic diagram of carbonate weathering and carbon sequestration processes in different sources of soil−forming carbonates (modified from Monger et al., 2015)
图 10 碳酸盐世代分类示意图(据Monger et al.,2015修改)
Figure 10. Schematic diagram of carbonate generation classification (modified from Monger et al., 2015)
图 14 植物根系促进周围PC沉淀以及钙质根石(Rhizoliths)形成过程示意图(据Zamanian et al., 2016修改)
Figure 14. Schematic diagram of the process of PC precipitation surrounding plant roots and formation of Rhizoliths (modified from Zamanian et al., 2016)
表 1 全球干旱荒漠区CO2负通量报告统计(据Schlesinger,2017修改)
Table 1 Global negative CO2 flux reporting statistics for arid desert regions (modified from Schlesinger, 2017)
研究地点 年平均
降水量/
mm负通量/
(g C m−2 a−1)文献来源 墨西哥,下加利福尼亚州 174 39~52 Hastings et al., 2005 美国,莫哈韦沙漠 150 102~127 Jasoni et al., 2005;Wohlfahrt et al., 2008 中国,古尔班通古特沙漠 160 62~622 Xie et al., 2009 173 49 Liu et al., 2012 164 25 Ma et al., 2014 中国,宁夏 287 77 Jia et al., 2014 275 28 Liu et al., 2015a 中国,塔里木盆地 21 Li et al., 2015 表 2 基于δ13C值估算的不同地区土壤无机碳PC与LC占比
Table 2 Estimated percentage of soil inorganic carbon PC and LC in different regions based on δ13C values
地点 PC占比/
%PC含量/(g/kg) 文献来源 塔里木盆地阿拉尔垦区 1.33~35.7 1.34~56.36 李杨梅等,2018 内蒙古乌兰察布 17.4~83.6 42~177 张林等,2010 俄罗斯 20~50 / Morgun et al., 2008 俄罗斯 66.8~73.8 26.9~60.1 Ryskov et al., 2008 美国德克萨斯州 2~11,
9~20,
60~70,
17~100/ Nordt et al., 1998 美国德克萨斯州 40~90 / Rabenhorst et al., 1983 以色列 30~60 / Magaritz and Amiel, 1980 表 3 基于87Sr/86Sr值估算的不同地区土壤无机碳SPC与CPC占比
Table 3 Soil inorganic carbon SPC and CPC shares in different regions estimated based on 87Sr/86Sr values
地点 PC钙源/SPC占比 成土母质 文献来源 定
性摩洛哥阿特拉斯 来自降水以及基岩风化 玄武岩 Hamidi et al., 2001 智利阿塔卡马沙漠 沿海地区主要来自海洋气溶胶输入(>50%),
大陆内部主要来自基岩风化岩浆岩+灰岩+碎屑岩 Rech et al., 2003 印度西高止山脉 来自非钙质基岩风化以及风沙 片麻岩+花岗岩+绿岩 Durand et al., 2006 定
量西班牙两座火山岛 极少 岩浆岩+砂岩+风积物 Huerta et al., 2015 美国新墨西哥州 <2% 非钙质冲积物 Capo and Chadwick,1999 西班牙中部 2.7% ~ 7.8% 花岗岩 Chiquet et al., 1999 澳大利亚中南部 ~10% 花岗岩、玄武岩、角闪岩、绿岩、页岩 Dart et al., 2007 夏威夷岛 33% 玄武岩 Whipkey et al., 2000 美国西南部 39~58% 岩浆岩+灰岩 Naiman et al., 2000 印度南部 24%~82% 片麻岩+超镁质岩 Violette et al., 2010 喀麦隆远北地区 >50% 花岗岩+绿岩 Dietrich et al., 2017 注:定性指研究中基于87Sr/86Sr值推断PC的主要钙源,并未得到明确SPC占比的;定量指研究中基于87Sr/86Sr值得出明确SPC占比或来自硅酸岩风化钙源贡献比例的。 表 4 不同深度土壤中土壤无机碳占比
Table 4 Percentage of soil inorganic carbon in soils at different depths
研究地点 不同深度SIC分布结论 文献来源 中国 1~3 m储量占比54.9%~88.5% Li et al., 2007 内蒙古 1~3 m储量占比>50% Wang et al., 2010 兰州 1~2 m储量占比50% Zhang et al., 2015 西班牙东南部 1~2 m储量占比51% Dı́az−Hernández et al., 2003 新疆 1 m以下储量占比>80%,3 m以下储量占比>50% Wang et al., 2013a 加拿大萨斯喀彻温省 深层土壤(C层)储量占比几乎100% Landi et al., 2003 内蒙古 0~30 cm、30~100 cm储量占比15%、85% Wang et al., 2013b 黄土高原 0~20 cm、20~50 cm、50~100 cm储量均值2.39、2.92、4.89 Pg Tan et al., 2014 新疆 0~30 cm、30~100 cm密度均值:耕地11.0、30.9 kg C m−2,灌木林地9.8、27.0 kg C m−2 Wang et al., 2015c 青藏高原 0~30 cm、0~50 cm、0~100 cm密度均值5.70、9.10、13.46 kg C m−2 Yang et al., 2010 黄河三角洲 0~20 cm、80~100 cm含量均值为10.48 g∙kg−1、12.72 g∙kg−1 Guo et al., 2016 伊朗西北部 表土平均含量(A层):7.9%;深层平均含量(C层):21.2% Raheb et al., 2017 表 5 不同地区土壤无机碳与土壤有机碳相关性汇总
Table 5 Summary of correlation between soil inorganic carbon and soil organic carbon in different regions
研究地点 SIC与SOC
相关性结论文献来源 甘肃省河西走廊中部 正相关 Su et al., 2010 以色列贝特谢安 Tamir et al., 2012 内蒙古、西藏 Shi et al., 2012 新疆焉耆盆地 Wang et al., 2014 新疆焉耆盆地 Wang et al., 2015b 新疆焉耆盆地 Wang et al., 2015c 黄河三角洲 Guo et al., 2016 中国河北衢州
黄土高原Bughio et al., 2016
Tong et al., 2020室内实验 负相关 Demoling et al., 2007 宁夏 Liu et al., 2014 兰州 Zhang et al., 2015 云南 Li et al., 2016 黄土高原 Zhao et al., 2016 黑河流域 Yang et al., 2018 青藏高原 Du and Gao, 2020 内蒙古、西藏 不相关 Shi et al., 2012 华北平原 Lu et al., 2020 西班牙巴塞罗那 PC与SOC碳
同位素线性相关,
具备成因联系Rovira and Vallejo,2008 美国华盛顿州 Stevenson et al., 2005 表 6 土地利用类型变化与不同土地覆盖对SIC的影响
Table 6 Effect of land use type change and different land cover on SIC
研究地点 研究结论 文献来源 黄土高原 耕地−草地:SIC减少 Liu et al., 2014 美国南部阿根廷潘帕斯草原 自然土地−灌溉耕地,SIC减少 Kim et al., 2020 俄罗斯库尔斯克 自然土地−灌溉耕地:SIC增加 Mikhailova and Post, 2006 新疆焉耆盆地 Wang et al., 2015b 新疆焉耆盆地 Wang et al., 2015c 美国西北部蛇河平原 Entry et al., 2004 中国 Wu et al., 2009 美国西南部 Nyachoti et al., 2019 新疆塔里木盆地 干旱盐碱地−灌溉耕地:SIC增加 Li et al., 2015 甘肃省河西走廊中部 沙地−灌木、林地、耕地:SIC增加 Su et al., 2010 华北平原 普通耕地−集约化种植耕地:SIC增加 Lu et al., 2020 综述 草地−耕地:SIC增加;沙地−林地:SIC增加;草地、耕地−林地:SIC减少 An et al., 2019 黄土高原 SIC密度:农田=草地>森林 Tan et al., 2014 中国 SIC密度:沙漠、草原>灌木丛、耕地>沼泽、森林、草甸 Mi et al., 2008 内蒙古 SIC密度:沙漠>灌木沙漠>灌木−草原>森林、草原 Wang et al., 2010 中国西北部黑河流域 SIC密度:温带草原>高山草甸 Yang et al., 2018 表 7 灌溉对土壤SIC的影响及可能原因总结
Table 7 Summary of the effect of irrigation in soil SIC and possible causes
相关性 可能原因 相关文献 研究地点 正相关 灌溉提供溶液环境,加强生物活动,
输入钙镁离子以及DIC,促进PC形成Wu et al., 2009 中国 Zhang et al., 2015 兰州 Bughio et al., 2016 河北衢州 Entry et al., 2004 美国西北部蛇河平原 Li et al., 2015 新疆塔里木盆地 Wang et al., 2016 美国新墨西哥州 Nyachoti et al., 2019 美国西南部 负相关 低EC(碳酸钙不饱和)的大量灌溉
水易造成SIC溶解流失Wu et al., 2008 加利福尼亚 Schindlbacher et al., 2019 德国拜罗伊特市 Kim et al., 2020 美国南部大平原,
阿根廷潘帕斯草原 -
[1] Amundson R, Stern L, Baisden T, Wang Y. 1998. The isotopic composition of soil and soil−respired CO2[J]. Geoderma, 82(1/3): 83−114. doi: 10.1016/S0016-7061(97)00098-0
[2] An H, Wu X, Zhang Y, Tang Z. 2019. Effects of land−use change on soil inorganic carbon: A meta−analysis[J]. Geoderma, 353: 273−282. doi: 10.1016/j.geoderma.2019.07.008
[3] Anand R R, Phang C, Wildman J E, Lintern M J. 1997. Genesis of some calcretes in the southern Yilgarn Craton, Western Australia: implications for mineral exploration[J]. Australian Journal of Earth Sciences, 44(1): 87−103. doi: 10.1080/08120099708728296
[4] Andrews J A, Schlesinger W H. 2001. Soil CO2 dynamics, acidification, and chemical weathering in a temperate forest with experimental CO2 enrichment[J]. Global Biogeochemical Cycles, 15(1): 149−162. doi: 10.1029/2000GB001278
[5] Archer D. 2011. The Global Carbon Cycle[M]. Princeton: Princeton University Press.
[6] Ball B A, Virginia R A, Barrett J E, Parsons A N, Wall D H. 2009. Interactions between physical and biotic factors influence CO2 flux in Antarctic dry valley soils[J]. Soil Biology and Biochemistry, 41(7): 1510−1517. doi: 10.1016/j.soilbio.2009.04.011
[7] Barker S L L, Cox S F. 2011. Oscillatory zoning and trace element incorporation in hydrothermal minerals: Insights from calcite growth experiments[J]. Geofluids, 11(1): 48−56. doi: 10.1111/j.1468-8123.2010.00305.x
[8] Batjes N H. 1996. Total carbon and nitrogen in the soils of the world[J]. European Journal of Soil Science, 47(2): 151−163. doi: 10.1111/j.1365-2389.1996.tb01386.x
[9] Bayat O, Karimi A, Amundson R. 2021. Stable isotope geochemistry of pedogenic carbonates in calcareous materials, Iran: A review and synthesis[J]. Geological Society Special Publication, 507(1): 255−272. doi: 10.1144/SP507-2019-236
[10] Berner R A. 1992. Weathering, plants, and the long−term carbon cycle[J]. Geochimica et Cosmochimica Acta, 56(8): 3225−3231. doi: 10.1016/0016-7037(92)90300-8
[11] Berner R A. 2004. The Phanerozoic Carbon Cycle: CO2 and O2[M]. New York: Oxford University Press.
[12] Berner R A, Lasaga A C, Garrels R M. 1983. Carbonate−silicate geochemical cycle and its effect on atmospheric carbon dioxide over the past 100 million years[J]. American Journal of Science, 283(7): 641−683. doi: 10.2475/ajs.283.7.641
[13] Berner R A, Raiswell R. 1983. Burial of organic carbon and pyrite sulfur in sediments over phanerozoic time: A new theory[J]. Geochimica et Cosmochimica Acta, 47(5): 855−862. doi: 10.1016/0016-7037(83)90151-5
[14] Berthelin J. 1988. Microbial weathering processes in natural environments[J]. Physical and Chemical Weathering in Geochemical Cycles, 251: 33−59.
[15] Birkeland P W. 1999. Soils and geomorphology (Book review)[J]. The Geographical Bulletin, 41(2): 121.
[16] Braissant O, Verrecchia E P, Aragno M. 2002. Is the contribution of bacteria to terrestrial carbon budget greatly underestimated?[J]. Naturwissenschaften, 89(8): 366−370. doi: 10.1007/s00114-002-0340-0
[17] Brock A L, Buck B J. 2005. A new formation process for calcic pendants from Pahranagat Valley, Nevada, USA, and implication for dating Quaternary landforms[J]. Quaternary Research, 63(3): 359−367. doi: 10.1016/j.yqres.2005.01.007
[18] Bruce J P. 1999. Carbon sequestration in soils[J]. Science, 54(1): 382−389.
[19] Bughio M A, Wang P, Meng F, Qing C, Kuzyakov Y, Wang X, Junejo S A. 2016. Neoformation of pedogenic carbonates by irrigation and fertilization and their contribution to carbon sequestration in soil[J]. Geoderma, 262: 12−19. doi: 10.1016/j.geoderma.2015.08.003
[20] Burgener L, Huntington K W, Hoke G D, Schauer A, Ringham M C, Latorre C, Díaz F P. 2016. Variations in soil carbonate formation and seasonal bias over > 4 km of relief in the western Andes (30 S) revealed by clumped isotope thermometry[J]. Earth and Planetary Science Letters, 441: 188−199. doi: 10.1016/j.jpgl.2016.02.033
[21] Capo R C, Chadwick O A. 1999. Sources of strontium and calcium in desert soil and calcrete[J]. Earth and Planetary Science Letters, 170(1/2): 61−72. doi: 10.1016/S0012-821X(99)00090-4
[22] Capo R C, Stewart B W, Chadwick O A. 1998. Strontium isotopes as tracers of ecosystem processes: theory and methods[J]. Geoderma, 82(1/3): 197−225. doi: 10.1016/S0016-7061(97)00102-X
[23] Cerling T E. 1984. The stable isotopic composition of modern soil carbonate and its relationship to climate[J]. Earth and Planetary Science Letters, 71(2): 229−240. doi: 10.1016/0012-821X(84)90089-X
[24] Chadwick O A, Sowers J M, Amundson R G. 1989. Morphology of calcite crystals in clast coatings from four soils in the Mojave Desert region[J]. Soil Science Society of America Journal, 53(1): 211−219. doi: 10.2136/sssaj1989.03615995005300010038x
[25] Chiquet A, Michard A, Nahon D, Hamelin B. 1999. Atmospheric input vs in situ weathering in the genesis of calcretes: an Sr isotope study at Gálvez (Central Spain)[J]. Geochimica et Cosmochimica Acta, 63(3−4): 311−323. doi: 10.1016/S0016-7037(98)00271-3
[26] Cole J J, Prairie Y T, Caraco N F, McDowell W H, Tranvik L J, Striegl R G, Duarte C M, Kortelainen P, Downing J A, Middelburg J J, Melack J. 2007. Plumbing the global carbon cycle: Integrating inland waters into the terrestrial carbon budget[J]. Ecosystems, 10: 172−185. doi: 10.1007/s10021-006-9013-8
[27] Da J, Zhang Y G, Li G, Meng X, Ji J. 2019. Low CO2 levels of the entire Pleistocene epoch[J]. Nature Communications, 10(1): 4342. doi: 10.1038/s41467-019-12357-5
[28] Da J, Zhang Y G, Li G, Meng X, Ji J. 2020. Aridity−driven decoupling of δ13C between pedogenic carbonate and soil organic matter[J]. Geology, 48(10): 981−985. doi: 10.1130/G47241.1
[29] Da Jiawei. 2020. Quantitative Reconstruction of Paleoatmospheric CO2 Levels Using Pedogenic Carbonates from the Chinese Loess Plateau[D]. Nanjing: Nanjing University (in Chinese with English abstract).
[30] Dart R C, Barovich K M, Chittleborough D J, Hill S M. 2007. Calcium in regolith carbonates of central and southern Australia: Its source and implications for the global carbon cycle[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 249(3/4): 322−334.
[31] Demoling F, Figueroa D, Bååth E. 2007. Comparison of factors limiting bacterial growth in different soils[J]. Soil Biology and Biochemistry, 39(10): 2485−2495. doi: 10.1016/j.soilbio.2007.05.002
[32] Dı́az−Hernández J L, Fernández E B, González J L. 2003. Organic and inorganic carbon in soils of semiarid regions: A case study from the Guadix–Baza basin (Southeast Spain)[J]. Geoderma, 114(1/2): 65−80. doi: 10.1016/S0016-7061(02)00342-7
[33] Dietrich F, Diaz N, Deschamps P, Ngatcha B N, Sebag D, Verrecchia E P. 2017. Origin of calcium in pedogenic carbonate nodules from silicate watersheds in the Far North Region of Cameroon: Respective contribution of in situ weathering source and dust input[J]. Chemical Geology, 460: 54−69. doi: 10.1016/j.chemgeo.2017.04.015
[34] Du C, Gao Y. 2020. Opposite patterns of soil organic and inorganic carbon along a climate gradient in the alpine steppe of northern Tibetan Plateau[J]. Catena, 186: 104366. doi: 10.1016/j.catena.2019.104366
[35] Durand N, Ahmad S M, Hamelin B, Gunnell Y, Curmi P. 2006. Origin of Ca in South Indian calcretes developed on metamorphic rocks[J]. Journal of Geochemical Exploration, 88(1/3): 275−278. doi: 10.1016/j.gexplo.2005.08.055
[36] Eisenlohr L, Meteva K, Gabrovšek F, Dreybrodt W. 1999. The inhibiting action of intrinsic impurities in natural calcium carbonate minerals to their dissolution kinetics in aqueous H2O−CO2 solutions[J]. Geochimica et Cosmochimica Acta, 63(7/8): 989−1001. doi: 10.1016/S0016-7037(98)00301-9
[37] Emmerich W E. 2003. Carbon dioxide fluxes in a semiarid environment with high carbonate soils[J]. Agricultural and Forest Meteorology, 116(1−2): 91−102. doi: 10.1016/S0168-1923(02)00231-9
[38] Entry J A, Sojka R E, Shewmaker G E. 2004. Irrigation increases inorganic carbon in agricultural soils[J]. Environmental Management, 33: S309−S317.
[39] Eswaran H. 2000. Global carbon stock[J]. Global Climate Change and Pedogenic Carbonates, 15−25.
[40] Fa K Y, Liu J B, Zhang Y Q, Wu B, Qin S G, Feng W, Lai Z R. 2015. CO2 absorption of sandy soil induced by rainfall pulses in a desert ecosystem[J]. Hydrological Processes, 29(8): 2043−2051. doi: 10.1002/hyp.10350
[41] Fa Keyu, Lei Guangchun, Zhang Yuqing, Liu Jiabin. 2018. Carbon exchange process between atmosphere and soil in desert soils[J]. Advances in Earth Science, 33(5): 464 (in Chinese with English abstract).
[42] Fa K, Xie E, Zhao X, Wang C. 2021. Natural water input deposits little atmospheric carbon into groundwater in a desert[J]. Catena, 199: 105097. doi: 10.1016/j.catena.2020.105097
[43] Fang Jingyun, Guo Zhaodi. 2007. Looking for missing carbon sinks from terrestrial ecosystems[J]. Chinese Journal of Nature, 29(1): 1−6 (in Chinese with English abstract).
[44] Ferdush J, Paul V. 2021. A review on the possible factors influencing soil inorganic carbon under elevated CO2[J]. Catena, 204: 105434. doi: 10.1016/j.catena.2021.105434
[45] Fernández−Ugalde O, Virto I, Barré P, Apesteguía M, Enrique A, Imaz M J, Bescansa P. 2014. Mechanisms of macroaggregate stabilisation by carbonates: implications for organic matter protection in semi−arid calcareous soils[J]. Soil Research, 52(2): 180−192. doi: 10.1071/SR13234
[46] Finneran D W, Morse J W. 2009. Calcite dissolution kinetics in saline waters[J]. Chemical Geology, 268(1/2): 137−146. doi: 10.1016/j.chemgeo.2009.08.006
[47] Gabitov R I, Gaetani G A, Watson E B, Cohen A L, Ehrlich H L. 2008. Experimental determination of growth rate effect on U6+ and Mg2+ partitioning between aragonite and fluid at elevated U6+ concentration[J]. Geochimica et Cosmochimica Acta, 72(16): 4058−4068. doi: 10.1016/j.gca.2008.05.047
[48] Gao Y, Zhang P, Liu J. 2020. One third of the abiotically−absorbed atmospheric CO2 by the loess soil is conserved in the solid phase[J]. Geoderma, 374: 114448. doi: 10.1016/j.geoderma.2020.114448
[49] Gile L H, Peterson F F, Grossman R B. 1966. Morphological and genetic sequences of carbonate accumulation in desert soils[J]. Soil Science, 101(5): 347−360. doi: 10.1097/00010694-196605000-00001
[50] Gocke M, Pustovoytov K, Kuzyakov Y. 2011. Carbonate recrystallization in root−free soil and rhizosphere of Triticum aestivum and Lolium perenne estimated by 14C labeling[J]. Biogeochemistry, 103: 209−222. doi: 10.1007/s10533-010-9456-z
[51] Grossman R B, Ahrens R J, Gile L H, Montoya C E, Chadwick O A. 1995. Areal evaluation of organic and carbonate carbon in a desert area of southern New Mexico[C]//Lal R et al.(eds.). Soils and Global Change: Boca Raton. Florida: Lewis Publishers, 81−92.
[52] Guo Y, Wang X, Li X, Wang J, Xu M, Li D. 2016. Dynamics of soil organic and inorganic carbon in the cropland of upper Yellow River Delta, China[J]. Scientific Reports, 6(1): 36105. doi: 10.1038/srep36105
[53] Hamada Y, Tanaka T. 2001. Dynamics of carbon dioxide in soil profiles based on long−term field observation[J]. Hydrological Processes, 15(10): 1829−1845. doi: 10.1002/hyp.242
[54] Hamerlynck E P, Scott R L, Sánchez−Cañete E P, Barron−Gafford G A. 2013. Nocturnal soil CO2 uptake and its relationship to subsurface soil and ecosystem carbon fluxes in a Chihuahuan Desert shrubland[J]. Journal of Geophysical Research: Biogeosciences, 118(4): 1593−1603. doi: 10.1002/2013JG002495
[55] Hamidi E M, Colin F, Michard A, Boulangé B, Nahon D. 2001. Isotopic tracers of the origin of Ca in a carbonate crust from the Middle Atlas, Morocco[J]. Chemical Geology, 176(1−4): 93−104. doi: 10.1016/S0009-2541(00)00373-9
[56] Hamilton S K, Kurzman A L, Arango C, Jin L, Robertson G P. 2007. Evidence for carbon sequestration by agricultural liming[J]. Global Biogeochemical Cycles, 21(2).
[57] Han Min, Xu Changchun, Long Yunxia, Liu Fang. 2022. Simulation and prediction of changes in carbon storage and carbon source/sink under different land use scenarios in arid region of Northwest China[J]. Bulletin of Soil and Water Conservation, 42(3): 335−344 (in Chinese with English abstract).
[58] Hastings S J, Oechel W C, Muhlia−Melo A. 2005. Diurnal, seasonal and annual variation in the net ecosystem CO2 exchange of a desert shrub community (Sarcocaulescent) in Baja California, Mexico[J]. Global Change Biology, 11(6): 927−939. doi: 10.1111/j.1365-2486.2005.00951.x
[59] Hoefs J, Hoefs J. 1997. Stable Isotope Geochemistry[M]. Berlin: Springer.
[60] Hoegberg P, Fan H, Quist M, Binkley D A N, Tamm C O. 2006. Tree growth and soil acidification in response to 30 years of experimental nitrogen loading on boreal forest[J]. Global Change Biology, 12(3): 489−499. doi: 10.1111/j.1365-2486.2006.01102.x
[61] Huang B, Wang J. 2006. Effects of long−term application fertilizer on carbon storage in calcareous meadow soil[J]. Journal of Agro−Environment Science, 25(1).
[62] Huang Qiaoyun, Lin Qimei, Xu Jianming. 2015. Soil Biochemistry[M]. Beijing: Higher Education Press (in Chinese).
[63] Huerta P, Rodríguez−Berriguete Á, Martín−García R, Martín−Pérez A, Fernández Á L I, Alonso−Zarza A M. 2015. The role of climate and aeolian dust input in calcrete formation in volcanic islands (Lanzarote and Fuerteventura, Spain)[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 417: 66−79.
[64] Jacobson A D, Blum J D, Chamberlain C P, Poage M A, Sloan V F. 2002. Ca/Sr and Sr isotope systematics of a Himalayan glacial chronosequence: carbonate versus silicate weathering rates as a function of landscape surface age[J]. Geochimica et Cosmochimica Acta, 66(1): 13−27. doi: 10.1016/S0016-7037(01)00755-4
[65] Jasoni R L, Smith S D, Arnone III J A. 2005. Net ecosystem CO2 exchange in Mojave Desert shrublands during the eighth year of exposure to elevated CO2[J]. Global Change Biology, 11(5): 749−756.
[66] Jia X, Zha T S, Wu B, Zhang Y Q, Gong J N, Qin S G, Chen G P, Qian D, Kellomäki S, Peltola H. 2014. Biophysical controls on net ecosystem CO2 exchange over a semiarid shrubland in northwest China[J]. Biogeosciences, 1(17): 4679−4693.
[67] Joos F. 1994. Imbalance in the budget[J]. Nature, 370(6486): 18l−182.
[68] Khalidy R, Arnaud E, Santos R M. 2022. Natural and human−induced factors on the accumulation and migration of pedogenic carbonate in soil: A review[J]. Land, 11(9): 1448. doi: 10.3390/land11091448
[69] Kim J H, Jobbágy E G, Richter D D, Trumbore S E, Jackson R B. 2020. Agricultural acceleration of soil carbonate weathering[J]. Global Change Biology, 26(10): 5988−6002. doi: 10.1111/gcb.15207
[70] Kraimer R A, Monger H C. 2009. Carbon isotopic subsets of soil carbonate—A particle size comparison of limestone and igneous parent materials[J]. Geoderma, 150(1/2): 1−9. doi: 10.1016/j.geoderma.2008.11.042
[71] Kuzyakov Y, Domanski G. 2002. Model for rhizodeposition and CO2 efflux from planted soil and its validation by 14C pulse labelling of ryegrass[J]. Plant and Soil, 239: 87−102. doi: 10.1023/A:1014939120651
[72] Kuzyakov Y. 2006. Sources of CO2 efflux from soil and review of partitioning methods[J]. Soil Biology and Biochemistry, 38(3): 425−448. doi: 10.1016/j.soilbio.2005.08.020
[73] Lal R, Kimble J M, Stewart B A, Eswaran H. 1999. Global Climate Change and Pedogenic Carbonates[M]. United States: CRC Press.
[74] Lal R. 2004. Soil carbon sequestration impacts on global climate change and food security[J]. Science, 304(5677): 1623−1627. doi: 10.1126/science.1097396
[75] Lal R. 2008. Sequestration of atmospheric CO2 in global carbon pools[J]. Energy & Environmental Science, 1(1): 86−100.
[76] Lal R. 2019. Carbon Cycling in Global Drylands[J]. Current Climate Change Reports, 5: 221−232. doi: 10.1007/s40641-019-00132-z
[77] Landi A, Mermut A R, Anderson D W. 2003. Origin and rate of pedogenic carbonate accumulation in Saskatchewan soils, Canada[J]. Geoderma, 117(1/2): 143−156. doi: 10.1016/S0016-7061(03)00161-7
[78] Li Fushan, Han Guilin. 2012. Strontium isotopes in forest ecosystem study: A review[J]. Chinese Journal of Ecology, 31(11): 2935−2942(in Chinese with English abstract).
[79] Li S, Li H, Yang C, Wang Y, Xue H, Niu Y. 2016. Rates of soil acidification in tea plantations and possible causes[J]. Agriculture, Ecosystems & Environment, 233: 60−66.
[80] Li Y, Wang Y G, Houghton R A, Tang L S. 2015. Hidden carbon sink beneath desert[J]. Geophysical Research Letters, 42(14): 5880−5887. doi: 10.1002/2015GL064222
[81] Li Yan, Wang Yugang, Tang Lisong. 2016. The effort to re−activate the inorganic carbon in soil[J]. Acta Pedologica Sinica, 53(4): 845−849 (in Chinese with English abstract).
[82] Li Yangmei, Gong Lu, An Shenqun, Sun Li, Chen Xin. 2018. Transfer of soil organic carbon to inorganic carbon in arid oasis based on stable carbon isotope technique[J]. Environmental Science, 39(8): 3867−3875 (in Chinese with English abstract).
[83] Li Z P, Han F X, Su Y, Zhang T L, Sun B, Monts D L, Plodinec M J. 2007. Assessment of soil organic and carbonate carbon storage in China[J]. Geoderma, 138(1/2): 119−126. doi: 10.1016/j.geoderma.2006.11.007
[84] Lintern M J, Sheard M J, Chivas A R. 2006. The source of pedogenic carbonate associated with gold−calcrete anomalies in the western Gawler Craton, South Australia[J]. Chemical Geology, 235(3/4): 299−324. doi: 10.1016/j.chemgeo.2006.08.001
[85] Liu J, Fa K, Zhang Y, Wu B, Qin S, Jia X. 2015a. Abiotic CO2 uptake from the atmosphere by semiarid desert soil and its partitioning into soil phases[J]. Geophysical Research Letters, 42(14): 5779−5785. doi: 10.1002/2015GL064689
[86] Liu J, Feng W, Zhang Y, Jia X, Wu B, Qin S, Fa K, Lai Z. 2015b. Abiotic CO2 exchange between soil and atmosphere and its response to temperature[J]. Environmental Earth Sciences, 73: 2463−2471. doi: 10.1007/s12665-014-3595-9
[87] Liu Lian, Yin Qiuzhen, Wu Haibin, Guo Zhengtang. 2010. Carbon isotopic compositions of pore and matrix carbonates in carbonate nodules, and origin of carbonate formation[J]. Chinese Science Bulletin, 55(26): 2647−2650 (in Chinese).
[88] Liu R, Li Y, Wang Q X. 2012. Variations in water and CO2 fluxes over a saline desert in western China[J]. Hydrological Processes, 26(4): 513−522.
[89] Liu T, Wang L, Feng X, Zhang J, Ma T, Wang X, Liu Z. 2018. Comparing soil carbon loss through respiration and leaching under extreme precipitation events in arid and semiarid grasslands[J]. Biogeosciences, 15(5): 1627−1641. doi: 10.5194/bg-15-1627-2018
[90] Liu W, Wei J, Cheng J, Li W. 2014. Profile distribution of soil inorganic carbon along a chronosequence of grassland restoration on a 22−year scale in the Chinese Loess Plateau[J]. Catena, 121: 321−329. doi: 10.1016/j.catena.2014.05.019
[91] Liu Z, Dreybrodt W, Wang H. 2010. A new direction in effective accounting for the atmospheric CO2 budget: Considering the combined action of carbonate dissolution, the global water cycle and photosynthetic uptake of DIC by aquatic organisms[J]. Earth−Science Reviews, 99(3/4): 162−172. doi: 10.1016/j.earscirev.2010.03.001
[92] Liu Z H. 2011. Is pedogenic carbonate an important atmospheric CO2 sink?[J]. Chinese Science Bulletin, 56(35): 3794−3796. doi: 10.1007/s11434-010-4288-8
[93] López−Ballesteros A, Serrano−Ortiz P, Kowalski A S, Sánchez−Canete E P, Scott R L, Domingo F. 2017. Subterranean ventilation of allochthonous CO2 governs net CO2 exchange in a semiarid Mediterranean grassland[J]. Agricultural and Forest Meteorology, 234: 115−126.
[94] Lu T, Wang X, Xu M, Yu Z, Luo Y, Smith P. 2020. Dynamics of pedogenic carbonate in the cropland of the North China Plain: Influences of intensive cropping and salinization[J]. Agriculture, Ecosystems & Environment, 292: 106820.
[95] Lucas R W, Klaminder J, Futter M N, Bishop K H, Egnell G, Laudon H, Högberg P. 2011. A meta−analysis of the effects of nitrogen additions on base cations: implications for plants, soils, and streams[J]. Forest Ecology and Management, 262(2): 95−104. doi: 10.1016/j.foreco.2011.03.018
[96] Ma J, Liu R, Tang L S, Lan Z D, Li Y. 2014. A downward CO2 flux seems to have nowhere to go[J]. Biogeosciences, 11(22): 6251−6262. doi: 10.5194/bg-11-6251-2014
[97] Ma J, Wang Z Y, Stevenson B A, Zheng X J, Li Y. 2013. An inorganic CO2 diffusion and dissolution process explains negative CO2 fluxes in saline/alkaline soils[J]. Scientific Reports, 3(1): 2025. doi: 10.1038/srep02025
[98] Ma Y F, Gao Y H, Feng Q L. 2010. Effects of pH and temperature on CaCO3 crystallization in aqueous solution with water soluble matrix of pearls[J]. Journal of Crystal Growth, 312(21): 3165−3170. doi: 10.1016/j.jcrysgro.2010.07.053
[99] Magaritz M, Amiel A J. 1980. Calcium carbonate in a calcareous soil from the Jordan Valley, Israel: Its origin as revealed by the stable carbon isotope method[J]. Soil Science Society of America Journal, 44(5): 1059−1062. doi: 10.2136/sssaj1980.03615995004400050037x
[100] Marchant B P, Villanneau E J, Arrouays D, Saby N P A, Rawlins B G. 2015. Quantifying and mapping topsoil inorganic carbon concentrations and stocks: Approaches tested in France[J]. Soil Use and Management, 31(1): 29−38. doi: 10.1111/sum.12158
[101] Marion G M, Introne D S, Van Cleve K. 1991. The stable isotope geochemistry of CaCO3 on the Tanana River floodplain of interior Alaska, USA: composition and mechanisms of formation[J]. Chemical Geology: Isotope Geoscience Section, 86(2): 97−110. doi: 10.1016/0168-9622(91)90056-3
[102] Markewitz D, Richter D D, Allen H L, Urrego J B. 1998. Three decades of observed soil acidification in the Calhoun Experimental Forest: Has acid rain made a difference?[J]. Soil Science Society of America Journal, 62(5): 1428−1439. doi: 10.2136/sssaj1998.03615995006200050040x
[103] Martin J B. 2017. Carbonate minerals in the global carbon cycle[J]. Chemical Geology, 449: 58−72. doi: 10.1016/j.chemgeo.2016.11.029
[104] Meng X, Liu L, Balsam W, Li S, He T, Chen J, Ji J. 2015. Dolomite abundance in Chinese loess deposits: A new proxy of monsoon precipitation intensity[J]. Geophysical Research Letters, 42(23): 10391−10398.
[105] Meng X, Liu L, Wang X T, Balsam W, Chen J, Ji J. 2018. Mineralogical evidence of reduced East Asian summer monsoon rainfall on the Chinese loess plateau during the early Pleistocene interglacials[J]. Earth and Planetary Science Letters, 486: 61−69. doi: 10.1016/j.jpgl.2017.12.048
[106] Mi N A, Wang S, Liu J, Yu G, Zhang W, Jobbagy E. 2008. Soil inorganic carbon storage pattern in China[J]. Global Change Biology, 14(10): 2380−2387. doi: 10.1111/j.1365-2486.2008.01642.x
[107] Mikhailova E A, Post C J. 2006. Effects of land use on soil inorganic carbon stocks in the Russian Chernozem[J]. Journal of Environmental Quality, 35(4): 1384−1388. doi: 10.2134/jeq2005.0151
[108] Monger H C, Daugherty L A, Lindemann W C, Liddell C M. 1991. Microbial precipitation of pedogenic calcite[J]. Geology, 19(10): 997−1000. doi: 10.1130/0091-7613(1991)019<0997:MPOPC>2.3.CO;2
[109] Monger H C, Gallegos R A. 2000. Biotic and abiotic processes and rates of pedogenic carbonate accumulation in the southwestern United States—relationship to atmospheric CO2 sequestration[C]// Lal R, Kimble J M, Eswaran H, Stewart B A (eds. ). Global Climate Change and Pedogenic Carbonates. Boca Raton: Lewis Publishers, 273–290.
[110] Monger H C, Kraimer R A, Khresat S E, Cole D R, Wang X, Wang J. 2015. Sequestration of inorganic carbon in soil and groundwater[J]. Geology, 43(5): 375−378. doi: 10.1130/G36449.1
[111] Monger, H. C. 2014. Soils as generators and sinks of inorganic carbon in geologic time[J]. Soil Carbon, 27−36.
[112] Morgun E G, Kovda I V, Ryskov Y G, Oleinik S A. 2008. Prospects and problems of using the methods of geochemistry of stable carbon isotopes in soil studies[J]. Eurasian Soil Science, 41(3): 265−275. doi: 10.1134/S1064229308030046
[113] Naiman Z, Quade J, Patchett P J. 2000. Isotopic evidence for eolian recycling of pedogenic carbonate and variations in carbonate dust sources throughout the southwest United States[J]. Geochimica et Cosmochimica Acta, 64(18): 3099−3109. doi: 10.1016/S0016-7037(00)00410-5
[114] Naorem A, Jayaraman S, Dalal R C, Patra A, Rao C S, Lal R. 2022. Soil inorganic carbon as a potential sink in carbon storage in dryland soils—A review[J]. Agriculture, 12(8): 1256. doi: 10.3390/agriculture12081256
[115] Neira J, Ortiz M, Morales L, Acevedo E. 2015. Oxygen diffusion in soils: understanding the factors and processes needed for modeling[J]. Chilean Journal of Agricultural Research, 75: 35−44.
[116] Nordt L C, Hallmark C T, Wilding L P, Boutton T W. 1998. Quantifying pedogenic carbonate accumulations using stable carbon isotopes[J]. Geoderma, 82(1/3): 115−136. doi: 10.1016/S0016-7061(97)00099-2
[117] Nyachoti S, Jin L, Tweedie C E, Ma L. 2019. Insight into factors controlling formation rates of pedogenic carbonates: A combined geochemical and isotopic approach in dryland soils of the US Southwest[J]. Chemical Geology, 527: 118503. doi: 10.1016/j.chemgeo.2017.10.014
[118] Oh N H, Richter D D, Jr D D R. 2004. Soil acidification induced by elevated atmospheric CO2[J]. Global Change Biology, 10(11): 1936−1946. doi: 10.1111/j.1365-2486.2004.00864.x
[119] Ouyang X, Zhou G, Huang Z, Liu J, Zhang D, Jiong L. 2008. Effect of simulated acid rain on potential carbon and nitrogen mineralization in forest soils[J]. Pedosphere, 18(4): 503−514. doi: 10.1016/S1002-0160(08)60041-7
[120] Pan Genxing. 1999. Pedogenic carbonates in aridic soils of China and the significance in terrestrial carbon transfer[J]. Journal of Nanjing Agricultural University, 22(1): 51(in Chinese with English abstract).
[121] Parsons A N, Barrett J E, Wall D H, Virginia R A. 2004. Soil carbon dioxide flux in Antarctic dry valley ecosystems[J]. Ecosystems, 7: 286−295.
[122] Pustovoytov K. 2003. Growth rates of pedogenic carbonate coatings on coarse clasts[J]. Quaternary International, 106: 131−140.
[123] Quade J, Cerling T E, Bowman J R. 1989. Systematic variations in the carbon and oxygen isotopic composition of pedogenic carbonate along elevation transects in the southern Great Basin, United States[J]. Geological Society of America Bulletin, 101(4): 464−475. doi: 10.1130/0016-7606(1989)101<0464:SVITCA>2.3.CO;2
[124] Raheb A, Heidari A, Mahmoodi S. 2017. Organic and inorganic carbon storage in soils along an arid to dry sub−humid climosequence in northwest of Iran[J]. Catena, 153: 66−74. doi: 10.1016/j.catena.2017.01.035
[125] Raza S, Miao N, Wang P Z, Ju X T, Chen Z J, Zhou J B, Kuzyakov Y. 2020. Dramatic loss of inorganic carbon by nitrogen‐induced soil acidification in Chinese croplands[J].Global Change Biology, 26(6): 3738−3751.
[126] Raza S, Zamanian K, Ullah S, Kuzyakov Y, Virto I, Zhou J. 2021. Inorganic carbon losses by soil acidification jeopardize global efforts on carbon sequestration and climate change mitigation[J]. Journal of Cleaner Production, 315: 128036. doi: 10.1016/j.jclepro.2021.128036
[127] Rech J A, Quade J, Hart W S. 2003. Isotopic evidence for the source of Ca and S in soil gypsum, anhydrite and calcite in the Atacama Desert, Chile[J]. Geochimica et Cosmochimica Acta, 67(4): 575−586. doi: 10.1016/S0016-7037(02)01175-4
[128] Rengel Z. 2003. Handbook of Soil Acidity[M]. Panama: CRC Press.
[129] Rousk J, Bååth E, Brookes P C, Lauber C L, Lozupone C, Caporaso J G, Knight R, Fierer N. 2010. Soil bacterial and fungal communities across a pH gradient in an arable soil[J]. The ISME Journal, 4(10): 1340−1351. doi: 10.1038/ismej.2010.58
[130] Rovira P, Vallejo V R. 2008. Changes in δ13C composition of soil carbonates driven by organic matter decomposition in a Mediterranean climate: A field incubation experiment[J]. Geoderma, 144(3/4): 517−534. doi: 10.1016/j.geoderma.2008.01.006
[131] Ryskov Y G, Demkin V A, Oleynik S A, Ryskova E A. 2008. Dynamics of pedogenic carbonate for the last 5000 years and its role as a buffer reservoir for atmospheric carbon dioxide in soils of Russia[J]. Global and Planetary Change, 61(1/2): 63−69. doi: 10.1016/j.gloplacha.2007.08.006
[132] Salomons W, Goudie A, Mook W G. 1978. Isotopic composition of calcrete deposits from Europe, Africa and India[J]. Earth Surface Processes, 3(1): 43−57. doi: 10.1002/esp.3290030105
[133] Sanderman J. 2012. Can management induced changes in the carbonate system drive soil carbon sequestration? A review with particular focus on Australia[J]. Agriculture, Ecosystems & Environment, 155: 70−77.
[134] Scharpenseel H W, Mtimet A, Freytag J. 2000. Global Climate Change and Pedogenic Carbonates[M]. Boca Raton, Florida: CRC Press, 27–42.
[135] Schindlbacher A, Beck K, Holzheu S, Borken W. 2019. Inorganic carbon leaching from a warmed and irrigated carbonate forest soil[J]. Frontiers in Forests and Global Change, 2: 40. doi: 10.3389/ffgc.2019.00040
[136] Schindler D W. 1999. Carbon cycling: The mysterious missing sink[J]. Nature, 398(6723): 105−106. doi: 10.1038/18111
[137] Schlesinger W H, Belnap J, Marion G. 2009. On carbon sequestration in desert ecosystems[J]. Global Change Biology, 15(6): 1488−1490. doi: 10.1111/j.1365-2486.2008.01763.x
[138] Schlesinger W H, Marion G M, Fonteyn P J. 1989. Stable isotope ratios and the dynamics of caliche in desert soils[C]//Stable Isotopes in Ecological Research. Springer New York, 309−317.
[139] Schlesinger W H. 1982. Carbon storage in the caliche of arid soils: A case study from Arizona[J]. Soil Science, 133(4): 247−255. doi: 10.1097/00010694-198204000-00008
[140] Schlesinger W H. 1985. The formation of caliche in soils of the Mojave Desert, California[J]. Geochimica et Cosmochimica Acta, 49(1): 57−66. doi: 10.1016/0016-7037(85)90191-7
[141] Schlesinger W H. 1999. Carbon sequestration in soils[J]. Science, 284(5423): 2095−2095. doi: 10.1126/science.284.5423.2095
[142] Schlesinger W H. 2000. Carbon sequestration in soils: Some cautions amidst optimism[J]. Agriculture, Ecosystems & Environment, 82(1/3): 121−127.
[143] Schlesinger W H. 2017. An evaluation of abiotic carbon sinks in deserts[J]. Global Change Biology, 23(1): 25−27. doi: 10.1111/gcb.13336
[144] Shanhun F L, Almond P C, Clough T J, Smith C M. 2012. Abiotic processes dominate CO2 fluxes in Antarctic soils[J]. Soil Biology and Biochemistry, 53: 99−111. doi: 10.1016/j.soilbio.2012.04.027
[145] Shi Y, Baumann F, Ma Y, Song C, Kühn P, Scholten T, He J S. 2012. Organic and inorganic carbon in the topsoil of the Mongolian and Tibetan grasslands: pattern, control and implications[J]. Biogeosciences, 9(6): 2287−2299. doi: 10.5194/bg-9-2287-2012
[146] Soltanian M R, Dai Z. 2017. Geologic CO2 sequestration: Progress and challenges[J]. Geomechanics and Geophysics for Geo−Energy and Geo−Resources, 3: 221−223. doi: 10.1007/s40948-017-0066-2
[147] Sombroek W G, Nachtergaele F O, Hebel A. 1993. Amounts, dynamics and sequestering of carbon in tropical and subtropical soils[J]. AMBIO: A Journal of the Human Environment, 22(7): 417
[148] Song X, Yang F, Wu H, Zhang J, Li D, Liu F, Zhao Y, Yang J, Ju B, Cai C, Huang B, Long H, Lu Y, Sui Y, Wang Q, Wu K, Zhang F, Zhang M, Shi Z, Ma W, Xin G, Qi Z, Chang Q, Ci E, Yuan D, Zhang Y, Bai J, Chen J, Chen J, Chen Y, Dong Y, Han C, Li L, Liu L, Pan J, Song F, Sun F, Wang D, Wang T, Wei X, Wu H, Zhao X, Zhou Q, Zhang G. 2022. Significant loss of soil inorganic carbon at the continental scale[J]. National Science Review, 9(2): nwab120. doi: 10.1093/nsr/nwab120
[149] Soper F M, McCalley C K, Sparks K, Sparks J P. 2017. Soil carbon dioxide emissions from the Mojave desert: Isotopic evidence for a carbonate source[J]. Geophysical Research Letters, 44(1): 245−251. doi: 10.1002/2016GL071198
[150] Stevenson B A, Kelly E F, McDonald E V, Busacca A J. 2005. The stable carbon isotope composition of soil organic carbon and pedogenic carbonates along a bioclimatic gradient in the Palouse region, Washington State, USA[J]. Geoderma, 124(1/2): 37−47. doi: 10.1016/j.geoderma.2004.03.006
[151] Stone R. 2008. Have desert researchers discovered a hidden loop in the carbon cycle?[J]. Science, 320(5882): 1409−1410 doi: 10.1126/science.320.5882.1409
[152] Su Y, Wang X, Yang R, Lee J. 2010. Effects of sandy desertified land rehabilitation on soil carbon sequestration and aggregation in an arid region in China[J]. Journal of Environmental Management, 91(11): 2109−2116. doi: 10.1016/j.jenvman.2009.12.014
[153] Takle E S, Massman W J, Brandle J R, Schmidt R A, Zhou X, Litvina I V, Garcia R, Doyle G, Rice C W. 2004. Influence of high−frequency ambient pressure pumping on carbon dioxide efflux from soil[J]. Agricultural and Forest Meteorology, 124(3/4): 193−206. doi: 10.1016/j.agrformet.2004.01.014
[154] Tamir G, Shenker M, Heller H, Bloom P R, Fine P, Bar−Tal A. 2012. Dissolution and re‐crystallization processes of active calcium carbonate in soil developed on tufa[J]. Soil Science Society of America Journal, 76(5): 1606−1613. doi: 10.2136/sssaj2012.0041
[155] Tan W F, Zhang R, Cao H, Huang C Q, Yang Q K, Wang M K, Koopal L K. 2014. Soil inorganic carbon stock under different soil types and land uses on the Loess Plateau region of China[J]. Catena, 121: 22−30. doi: 10.1016/j.catena.2014.04.014
[156] Tong L S, Fang N F, Xiao H B, Shi Z H. 2020. Sediment deposition changes the relationship between soil organic and inorganic carbon: Evidence from the Chinese Loess Plateau[J]. Agriculture, Ecosystems & Environment, 302: 107076.
[157] Violette A, Riotte J, Braun J J, Oliva P, Marechal J C, Sekhar M, Jeandel C, Subramanian S, Prunier J, Barbiero L, Dupre B. 2010. Formation and preservation of pedogenic carbonates in South India, links with paleo−monsoon and pedological conditions: Clues from Sr isotopes, U–Th series and REEs[J]. Geochimica et Cosmochimica Acta, 74(24): 7059−7085. doi: 10.1016/j.gca.2010.09.006
[158] Wang C, Li W, Yang Z, Chen Y, Shao W, Ji J. 2015a. An invisible soil acidification: Critical role of soil carbonate and its impact on heavy metal bioavailability[J]. Scientific Reports, 5(1): 12735. doi: 10.1038/srep12735
[159] Wang J P, Wang X J, Zhang J, Zhao C Y. 2015b. Soil organic and inorganic carbon and stable carbon isotopes in the Yanqi Basin of northwestern China[J]. European Journal of Soil Science, 66(1): 95−103. doi: 10.1111/ejss.12188
[160] Wang J, Monger C, Wang X, Serena M, Leinauer B. 2016. Carbon sequestration in response to grassland–shrubland–turfgrass conversions and a test for carbonate biomineralization in desert soils, New Mexico, USA[J]. Soil Science Society of America Journal, 80(6): 1591−1603. doi: 10.2136/sssaj2016.03.0061
[161] Wang Jianxiu, Wu Yuanbin, Yu Haipeng. 2013. Review of the technology for sequestration of carbon dioxide[J]. Chinese Journal of Underground Space and Engineering, 9(1): 81−90 (in Chinese with English abstract).
[162] Wang X, Wang J, Shi H, Guo Y. 2018. Carbon sequestration in arid lands: A mini review[J]. Carbon Cycle in the Changing Arid Land of China, 133−141.
[163] Wang X, Wang J, Xu M, Zhang W, Fan T, Zhang J. 2015c. Carbon accumulation in arid croplands of northwest China: pedogenic carbonate exceeding organic carbon[J]. Scientific Reports, 5(1): 11439. doi: 10.1038/srep11439
[164] Wang X, Xu M, Wang J, Zhang W, Yang X, Huang S, Liu H. 2014. Fertilization enhancing carbon sequestration as carbonate in arid cropland: assessments of long−term experiments in northern China[J]. Plant and Soil, 380: 89−100. doi: 10.1007/s11104-014-2077-x
[165] Wang Y, Hsieh Y P. 2002. Uncertainties and novel prospects in the study of the soil carbon dynamics[J]. Chemosphere, 49(8): 791−804. doi: 10.1016/S0045-6535(02)00381-8
[166] Wang Y, Li Y, Ye X, Chu Y, Wang X. 2010. Profile storage of organic/inorganic carbon in soil: From forest to desert[J]. Science of the Total Environment, 408(8): 1925−1931. doi: 10.1016/j.scitotenv.2010.01.015
[167] Wang Y, Wang Z, Li Y. 2013a. Storage/turnover rate of inorganic carbon and its dissolvable part in the profile of saline/alkaline soils[J]. PloS Ones, 8(11): e82029. doi: 10.1371/journal.pone.0082029
[168] Wang Z P, Han X G, Chang S X, Wang B, Yu Q, Hou L Y, Li L H. 2013b. Soil organic and inorganic carbon contents under various land uses across a transect of continental steppes in Inner Mongolia[J]. Catena, 109: 110−117. doi: 10.1016/j.catena.2013.04.008
[169] Whipkey C E, Capo R C, Chadwick O A, Stewart B W. 2000. The importance of sea spray to the cation budget of a coastal Hawaiian soil: a strontium isotope approach[J]. Chemical Geology, 168(1−2): 37−48. doi: 10.1016/S0009-2541(00)00187-X
[170] Wofsy S C. 2001. Where has all the carbon gone?[J]. Science, 292(5525): 2261−2263. doi: 10.1126/science.1061077
[171] Wohlfahrt G, Fenstermaker L F, Arnone III J A. 2008. Large annual net ecosystem CO2 uptake of a Mojave Desert ecosystem[J]. Global Change Biology, 14(7): 1475−1487. doi: 10.1111/j.1365-2486.2008.01593.x
[172] Wu H, Guo Z, Gao Q, Peng C. 2009. Distribution of soil inorganic carbon storage and its changes due to agricultural land use activity in China[J]. Agriculture, Ecosystems & Environment, 129(4): 413−421.
[173] Wu L, Wood Y, Jiang P, Li L, Pan G, Lu J, Chang A C, Enloe H A. 2008. Carbon sequestration and dynamics of two irrigated agricultural soils in California[J]. Soil Science Society of America Journal, 72(3): 808−814. doi: 10.2136/sssaj2007.0074
[174] Xia Xueqi, Yang Zhongfang, Yu Tao, Hou Qingye, Cheng Hangxin, Zhou Guohua. 2018. Series Parameters of Soil Carbon Density in China[M]. Beijing: Geological Publishing House (in Chinese).
[175] Xie J, Li Y, Zhai C, Li C, Lan Z. 2009. CO2 absorption by alkaline soils and its implication to the global carbon cycle[J]. Environmental Geology, 56: 953−961. doi: 10.1007/s00254-008-1197-0
[176] Yang F, Huang L, Yang R, Yang F, Li D, Zhao Y, Yang J, Zhang, G. 2018. Vertical distribution and storage of soil organic and inorganic carbon in a typical inland river basin, Northwest China[J]. Journal of Arid Land, 10: 183−201. doi: 10.1007/s40333-018-0051-9
[177] Yang S, Ding Z, Gu Z. 2014. Acetic acid−leachable elements in pedogenic carbonate nodules and links to the East−Asian summer monsoon[J]. Catena, 117: 73−80. doi: 10.1016/j.catena.2013.06.030
[178] Yang Y, Fang J, Ji C, Ma W, Mohammat A, Wang S F, Wang S P, Datta A, Robinson D, Smith P. 2012. Widespread decreases in topsoil inorganic carbon stocks across C hina's grasslands during 1980s–2000s[J]. Global Change Biology, 18(12): 3672−3680. doi: 10.1111/gcb.12025
[179] Yang Y, Fang J, Ji C, Ma W, Su S, Tang Z. 2010. Soil inorganic carbon stock in the Tibetan alpine grasslands[J]. Global Biogeochemical Cycles, 24(4).
[180] Yates E L, Detweiler A M, Iraci L T, Bebout B M, McKay C P, Schiro K, Sheffner E, Kelley C, Tadić J, Loewenstein M. 2013. Assessing the role of alkaline soils on the carbon cycle at a playa site[J]. Environmental Earth Sciences, 70(3): 1047−1056. doi: 10.1007/s12665-012-2194-x
[181] Yi Chenggong. 2022. Temporal and spatial Variation of Soil Moisture and Its Influencing Factors in Arid And Semi-Arid Areas of China from 2000 to 2020[D]. Xinyang: Xinyang Normal University (in Chinese with English abstract).
[182] Zamanian K, Kuzyakov Y. 2019. Contribution of soil inorganic carbon to atmospheric CO2: More important than previously thought[J]. Glob. Change Biol, 25: E1−E3. doi: 10.1111/gcb.14437
[183] Zamanian K, Pustovoytov K, Kuzyakov Y. 2016. Pedogenic carbonates: Forms and formation processes[J]. Earth−Science Reviews, 157: 1−17. doi: 10.1016/j.earscirev.2016.03.003
[184] Zamanian K, Zarebanadkouki M, Kuzyakov Y. 2018. Nitrogen fertilization raises CO2 efflux from inorganic carbon: A global assessment[J]. Global Change Biology, 24(7): 2810−2817. doi: 10.1111/gcb.14148
[185] Zamanian K. 2005. Study of Fashand-Hashtgerd Soils and Investigation on the Mechanisms of Petrocalcic Horizon Formation in These Soils[D]. Iran: Tehran University.
[186] Zamanian K, Zhou J, Kuzyakov Y. 2021. Soil carbonates: The unaccounted, irrecoverable carbon source[J]. Geoderma, 384: 114817. doi: 10.1016/j.geoderma.2020.114817
[187] Zhang F, Wang X, Guo T, Zhang P, Wang J. 2015. Soil organic and inorganic carbon in the loess profiles of Lanzhou area: Implications of deep soils[J]. Catena, 126: 68−74. doi: 10.1016/j.catena.2014.10.031
[188] Zhang Lin, Sun Xiangyang, Cao Jixin, Gao Chengda, Bao Yin. 2010. Transfer of organic carbon to inorganic carbonates in carbonate soil of desert grassland[J]. Arid Land Geography, 33(5): 732−739 (in Chinese).
[189] Zhao W, Zhang R, Huang C, Wang B, Cao H, Koopal L K, Tan W. 2016. Effect of different vegetation cover on the vertical distribution of soil organic and inorganic carbon in the Zhifanggou Watershed on the loess plateau[J]. Catena, 139: 191−198. doi: 10.1016/j.catena.2016.01.003
[190] Zhao X, Zhao C, Stahr K, Kuzyakov Y, Wei X. 2020. The effect of microorganisms on soil carbonate recrystallization and abiotic CO2 uptake of soil[J]. Catena, 192: 104592. doi: 10.1016/j.catena.2020.104592
[191] Zheng Jufeng, Cheng Kun, Pan Genxing, Smith Pete, Li Lianqing, Zhang Xuhui, Zheng Jinwei, Han Xiaojun, Du Yanling. 2011. Perspectives on studies on soil carbon stocks and the carbon sequestration potential of China[J]. Chinese Science Bulletin, 56(26): 2162−2173 (in Chinese).
[192] 达佳伟. 2020. 基于黄土高原成壤碳酸盐的古大气二氧化碳浓度定量重建研究[D]. 南京: 南京大学. [193] 法科宇, 雷光春, 张宇清, 刘加彬. 2018. 荒漠地区大气—土壤的碳交换过程[J]. 地球科学进展, 33(5): 464−472. [194] 方精云, 郭兆迪. 2007. 寻找失去的陆地碳汇[J]. 自然杂志, 29(1): 1−6. [195] 韩敏, 徐长春, 隆云霞, 刘芳. 2022. 西北干旱区不同土地利用情景下的碳储量及碳源/汇变化模拟与预估[J]. 水土保持通报, 42(3): 335−344. [196] 黄巧云, 林启美, 徐建明. 2015. 土壤生物化学[M]. 北京: 高等教育出版社. [197] 李富山, 韩贵琳. 2012. 锶同位素在森林生态系统研究中的进展[J]. 生态学杂志, 31(11): 2935−2942. [198] 李彦, 王玉刚, 唐立松. 2016. 重新被 “激活” 的土壤无机碳研究[J]. 土壤学报, 53(4): 845−849. [199] 李杨梅, 贡璐, 安申群, 孙力, 陈新. 2018. 基于稳定碳同位素技术的干旱区绿洲土壤有机碳向无机碳的转移[J]. 环境科学, 39(8): 3867−3875. [200] 刘恋, 尹秋珍, 吴海斌, 郭正堂. 2010. 成壤钙结核孔隙和基质碳酸盐碳同位素对比及其对碳酸盐成因的指示意义[J]. 科学通报, 55(26): 2647−2650. [201] 潘根兴. 1999. 中国干旱性地区土壤发生性碳酸盐及其在陆地系统碳转移的意义[J]. 南京农业大学学报, 22(1): 54−60. [202] 王建秀, 吴远斌, 于海鹏. 2013. 二氧化碳封存技术研究进展[J]. 地下空间与工程学报, 9(1): 81−90. [203] 夏学齐, 杨忠芳, 余涛, 侯青叶, 成杭新, 周国华. 2018. 中国土壤碳密度系列参数[M]. 北京: 地质出版社. [204] 易成功. 2022. 2000−2020年中国干旱半干旱区土壤湿度时空变化及影响因素[D]. 信阳: 信阳师范学院. [205] 张林, 孙向阳, 曹吉鑫, 高程达, 宝音贺希格. 2010. 荒漠草原碳酸盐岩土壤有机碳向无机碳酸盐的转移[J]. 干旱区地理, 33(5): 732−739. [206] 郑聚锋, 程琨, 潘根兴, Smith Pete, 李恋卿, 张旭辉, 郑金伟, 韩晓君, 杜彦玲. 2011. 关于中国土壤碳库及固碳潜力研究的若干问题[J]. 科学通报, 56(26): 2162−2173. -
期刊类型引用(3)
1. 阿地来·赛提尼亚孜,段星星,何峻岭,王翠翠,董越. 塔里木盆地北缘绿洲土壤碳储量及其碳密度的分布特征. 物探与化探. 2025(01): 229-238 .  百度学术
百度学术
2. 曾婷婷,王路明,杨康,胡春胜,李晓欣,董文旭. 长期外源有机物料添加对土壤无机碳库的影响. 中国生态农业学报(中英文). 2024(12): 2034-2044 .  百度学术
百度学术
3. 朱良琪,刘梅,陈良骥,牛文钰,尼庆伟. 浅谈调水工程“双碳”目标的实现路径——以南水北调东线工程为例. 环境生态学. 2024(12): 131-136 .  百度学术
百度学术
其他类型引用(3)



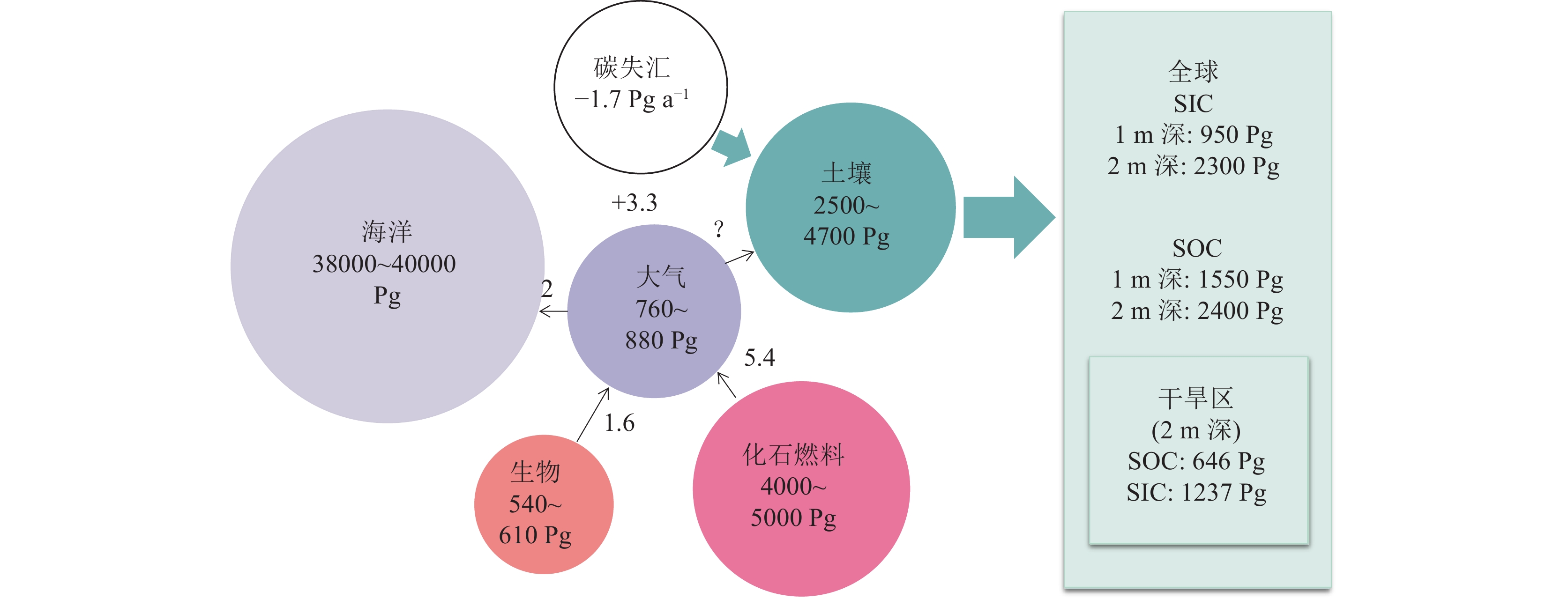
 下载:
下载: